Når en gruppe 1 metal reagerer, hvad sker der med de ydre skalelektroner af dets atomer?
Her er hvorfor:
* gruppe 1 -metaller (alkalimetaller) har en valenselektron i deres yderste skal.
* de er meget reaktive Fordi denne enkelt elektron let går tabt.
* for at opnå en stabil elektronkonfiguration (som de ædle gasser), De har en tendens til at miste denne elektron og danne en +1 -kation.
For eksempel, når natrium (NA) reagerer, mister det sin ydre elektron for at blive en natriumion (Na+), som har en stabil elektronkonfiguration.
Sammenfattende involverer reaktionen af gruppe 1 -metaller tabet af deres ydre skalelektron, hvilket resulterer i dannelsen af en positivt ladet ion.
Sidste artikelHvordan klassificerer vi magnesium?
Næste artikelHvad er det moderne kemiske navn på Aqua Vitae?
 Varme artikler
Varme artikler
-
 Molekylære porer kunne forbedre effektiviteten af olieraffinering og farmaceutisk fremstillingKAUST -forskere har udviklet en ultratynd membran, der kan gøre organisk opløsningsmiddelseparation mere bæredygtig og grønnere. Kredit:KAUST; Ivan Gromicho Skive-tynde membraner, der er skrædders
Molekylære porer kunne forbedre effektiviteten af olieraffinering og farmaceutisk fremstillingKAUST -forskere har udviklet en ultratynd membran, der kan gøre organisk opløsningsmiddelseparation mere bæredygtig og grønnere. Kredit:KAUST; Ivan Gromicho Skive-tynde membraner, der er skrædders -
 Fysikstuderende udvikler maskinlæringsmodel til energi- og miljøapplikationerEn fysikstuderende ved West Virginia University har skabt en ny maskinlæringsmodel, der har potentialet til at gøre søgningen efter energi- og miljømaterialer mere effektiv. Gihan Panapitiya, en dokt
Fysikstuderende udvikler maskinlæringsmodel til energi- og miljøapplikationerEn fysikstuderende ved West Virginia University har skabt en ny maskinlæringsmodel, der har potentialet til at gøre søgningen efter energi- og miljømaterialer mere effektiv. Gihan Panapitiya, en dokt -
 Undersøgelse afslører en unik måde for cellemigration på bløde viskoelastiske overfladerKredit:CC0 Public Domain Inde i din krop, cellebevægelse spiller en afgørende rolle i mange væsentlige biologiske processer, herunder sårheling, immunreaktioner og den potentielle spredning af kræ
Undersøgelse afslører en unik måde for cellemigration på bløde viskoelastiske overfladerKredit:CC0 Public Domain Inde i din krop, cellebevægelse spiller en afgørende rolle i mange væsentlige biologiske processer, herunder sårheling, immunreaktioner og den potentielle spredning af kræ -
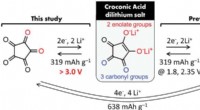 Et 4 V-klasse metalfrit organisk lithium-ion-batteri kommer tættere på virkeligheden3,0 V. Kredit:Advanced Science (2022). DOI:10.1002/advs.202200187 Et fælles forskerhold fra Tohoku University og University of California, Los Angeles (UCLA) har gjort et betydeligt fremskridt hen
Et 4 V-klasse metalfrit organisk lithium-ion-batteri kommer tættere på virkeligheden3,0 V. Kredit:Advanced Science (2022). DOI:10.1002/advs.202200187 Et fælles forskerhold fra Tohoku University og University of California, Los Angeles (UCLA) har gjort et betydeligt fremskridt hen
- Hvad er et eksempel på B2G?
- Infrarød NASA-billeder viser, at Tropical Storm Soulik forstærkes
- Årsagen til faserne månen er en cyklus, der er tæt på hvad?
- Forskere udvikler et nyt biofotovoltaiksystem
- Hvad er en måde, hvorpå og økosystem kan påvirke en kultur?
- Sådan produceres elektricitet fra forskellige frugter og grøntsager


