Hvad bestemmer, om energi vil blive frigivet eller absorberet under en kemisk reaktion?
Her er en sammenbrud:
* entalpi (H): Enthalpy er en termodynamisk egenskab, der repræsenterer det samlede energiindhold i et system. Det inkluderer intern energi (f.eks. Kinetisk energi af molekyler, potentiel energi af bindinger) plus produktet af tryk og volumen.
* Ændring i entalpi (ΔH): Dette er forskellen i entalpi mellem produkter og reaktanter ved en reaktion.
* eksotermisk reaktion: ΔH er negativ. Dette betyder, at produkterne har lavere entalpi end reaktanterne, hvilket indikerer, at energi frigøres til omgivelserne (f.eks. Varme, lys). Eksempler:forbrænding, eksplosion, neutralisering.
* endotermisk reaktion: ΔH er positiv. Dette betyder, at produkterne har højere entalpi end reaktanterne, hvilket indikerer, at energi absorberes fra omgivelserne. Eksempler:Meltis, fotosyntese, madlavning.
Faktorer, der påvirker ΔH, og derfor energiændringen:
* Bond Breaking: Brydning af kemiske bindinger kræver energiindgang (endotermisk).
* obligationsdannelse: Danning af nye kemiske bindinger frigiver energi (eksoterme).
* Styrke af obligationer: Stærkere obligationer kræver mere energi for at bryde og frigive mere energi, når de dannes.
* Intermolekylære kræfter: Interaktioner mellem molekyler kan også bidrage til energiændringer.
Kortfattet:
* Hvis den energi, der frigives under bindingsdannelse, overstiger den energi, der kræves for at bryde bindinger, er reaktionen eksoterm (ΔH <0).
* Hvis den energi, der kræves for at bryde bindinger, overstiger den energi, der frigives under bindingsdannelse, er reaktionen endotermisk (ΔH> 0).
Sidste artikelHvordan blev nitrogen opdaget?
Næste artikelHvilken ion er højest i interstitiel væske?
 Varme artikler
Varme artikler
-
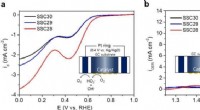 Forskere udvikler højtydende perovskitoxidkatalysatorer ved hjælp af metaloxidmaterialer med sen o…Figur 2. (a) ORR og (b) OER-aktiviteter for Sm 0,5 Sr 0,5 CoO 3−δ (δ =0,0, 0,1, og 0,2) i O 2 -mættet 0,1 M KOH ved en scanningshastighed på 10 mV s–1 og en rotationshastighed på 1600 rpm. Kre
Forskere udvikler højtydende perovskitoxidkatalysatorer ved hjælp af metaloxidmaterialer med sen o…Figur 2. (a) ORR og (b) OER-aktiviteter for Sm 0,5 Sr 0,5 CoO 3−δ (δ =0,0, 0,1, og 0,2) i O 2 -mættet 0,1 M KOH ved en scanningshastighed på 10 mV s–1 og en rotationshastighed på 1600 rpm. Kre -
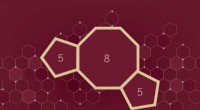 Gennembrudssyntesestrategi kan betyde bølge af nye medicinske forbindelserFSU-forskere har udtænkt en strategi til syntetisering af carbocykliske 5-8-5 smeltede ringsystemer, en molekylær struktur med potentielt bredt terapeutisk potentiale. Kredit:Benjamin Moten I farm
Gennembrudssyntesestrategi kan betyde bølge af nye medicinske forbindelserFSU-forskere har udtænkt en strategi til syntetisering af carbocykliske 5-8-5 smeltede ringsystemer, en molekylær struktur med potentielt bredt terapeutisk potentiale. Kredit:Benjamin Moten I farm -
 Ionvindteknologiens gennembrud tager flugtenGennembrudsflyvning -- Adrian Ieta, fra SUNY Oswegos fakultet for elektro- og computeringeniør, og SUNY Research Foundation har ansøgt om patent på teknologi, der resulterede i en første af sin slags
Ionvindteknologiens gennembrud tager flugtenGennembrudsflyvning -- Adrian Ieta, fra SUNY Oswegos fakultet for elektro- og computeringeniør, og SUNY Research Foundation har ansøgt om patent på teknologi, der resulterede i en første af sin slags -
 Forskere finder, at frøskal kunne føre til stærke, hård, men alligevel fleksible materialerKarakteristiske træk ved frøkappen af Portulaca oleracea , en årlig sukkulent almindeligvis kendt som verdolaga eller portulak. A) Foto af P. oleracea blomst , B) Fotografi af de bittesmå sorte fr
Forskere finder, at frøskal kunne føre til stærke, hård, men alligevel fleksible materialerKarakteristiske træk ved frøkappen af Portulaca oleracea , en årlig sukkulent almindeligvis kendt som verdolaga eller portulak. A) Foto af P. oleracea blomst , B) Fotografi af de bittesmå sorte fr


