Hvad sker der med de bundne Na plus og kluer, når de kommer ind i vandet?
1. Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brintatomer) og et lidt negativt afslutning (iltatom).
2. attraktion: Den positive ende af vandmolekylet (brint) tiltrækkes af den negativt ladede clion. Tilsvarende tiltrækkes den negative ende af vandmolekylet (ilt) af den positivt ladede Na+ -ion.
3. Omgivende: Flere vandmolekyler omgiver hver ion, der danner en hydratiseringsskal. Den elektrostatiske tiltrækning mellem ioner og vandmolekyler er stærk nok til at overvinde tiltrækningen mellem ionerne i krystalgitteret.
4. dissociation: Som et resultat af hydratiseringsprocessen bliver Na+ og Cl- ioner adskilt fra hinanden og er omgivet af vandmolekyler. De er nu frie til at bevæge sig uafhængigt i løsningen.
Nøgle takeaways:
* Hydrering: Processen med vandmolekyler omkring ioner kaldes hydrering.
* solvation: Den generelle proces med at opløse et opløst stof (som salt) i et opløsningsmiddel (som vand) kaldes solvation.
* Elektrostatisk attraktion: Tiltrækningen mellem ioner og vandmolekyler er baseret på elektrostatiske kræfter.
* dissociation: Processen med ioner, der adskilles i opløsning, kaldes dissociation.
Denne hydratiseringsproces og dissociation er grunden til, at salt opløses i vand, hvilket gør det til en god elektrolyt. De frie ioner kan udføre elektricitet.
Sidste artikelHvordan bruger du legering i en videnskabelig sætning?
Næste artikelHvor mange elektroner er der i den ydre skal af wolfram?
 Varme artikler
Varme artikler
-
 Hvordan inerte forbindelser kan stjæle ionerAlmindelige polymerer, der bruges til at efterligne den naturlige trængsel inde i cellen, kan stjæle ioner. De er rigtige iontyve! Kredit:IPC PAS, Grzegorz Krzyzewski Celler producerer mange forske
Hvordan inerte forbindelser kan stjæle ionerAlmindelige polymerer, der bruges til at efterligne den naturlige trængsel inde i cellen, kan stjæle ioner. De er rigtige iontyve! Kredit:IPC PAS, Grzegorz Krzyzewski Celler producerer mange forske -
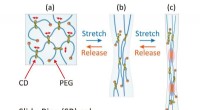 Biokompatible hydrogelmaterialer kan hurtigt komme sig efter mekanisk belastningEn strain gauge trækker prøver af hydrogel fra hinanden. (Øvre) En typisk gel med et hak skåret i venstre side snappede kort tid efter at den var strakt. (Midt) Den nye selvforstærkede gel havde et ha
Biokompatible hydrogelmaterialer kan hurtigt komme sig efter mekanisk belastningEn strain gauge trækker prøver af hydrogel fra hinanden. (Øvre) En typisk gel med et hak skåret i venstre side snappede kort tid efter at den var strakt. (Midt) Den nye selvforstærkede gel havde et ha -
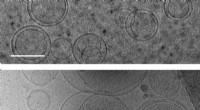 De første celler kan være opstået, fordi byggesten af proteiner stabiliserede membranerBilleder af membraner (cirkler) taget ved hjælp af transmissionselektronkryomikroskopi. Øverst:membraner i en opløsning, der ikke indeholder aminosyrer. Nederst:membraner i en opløsning indeholdende s
De første celler kan være opstået, fordi byggesten af proteiner stabiliserede membranerBilleder af membraner (cirkler) taget ved hjælp af transmissionselektronkryomikroskopi. Øverst:membraner i en opløsning, der ikke indeholder aminosyrer. Nederst:membraner i en opløsning indeholdende s -
 Datalagring ved hjælp af individuelle molekylerGrafisk animation af en mulig datahukommelse på atomskalaen:Et datalagringselement - bestående af kun 6 xenonatomer - flydende af en spændingspuls. Kredit:University of Basel, Institut for Fysik F
Datalagring ved hjælp af individuelle molekylerGrafisk animation af en mulig datahukommelse på atomskalaen:Et datalagringselement - bestående af kun 6 xenonatomer - flydende af en spændingspuls. Kredit:University of Basel, Institut for Fysik F
- Zimbabwes hovedstad løber tør, da haner blev afskåret for 2 millioner mennesker
- Effekten af tyngdekraften i solsystemet
- Hvad er lysstyrken på en stjerne sammenlignet med andre stjerner kaldet?
- Undersøgelse afslører dynamikken i overfladevandområder med 30 meter rumlig opløsning
- Ny NASA-undersøgelse tyder på, at månen engang havde en atmosfære
- En mulig ny måde at køle computerchips på


