Har isomerer de samme fysiske og kemiske egenskaber?
Her er hvorfor:
* isomerer er molekyler med den samme molekylære formel (samme antal og typer atomer), men forskellige arrangementer af de atomer.
* fysiske egenskaber Ligesom smeltepunkt, påvirkes kogepunktet, densitet og opløselighed af et molekyleform og struktur. Forskellige arrangementer af atomer fører til forskellige intermolekylære kræfter, der påvirker disse egenskaber.
* Kemiske egenskaber Ligesom reaktivitet og reaktionsprodukter påvirkes også af arrangementet af atomer. Funktionelle grupper (specifikke arrangementer af atomer) bestemmer, hvordan et molekyle interagerer med andre molekyler.
Eksempel:
* butan (C4H10) findes i to isomere former:n-butan og isobutan.
* n-butan er en lige kæde alkan med et højere kogepunkt (0 ° C) end isobutan (-12 ° C).
* isobutane er en forgrenet alkan. Dens forgrenede struktur reducerer overfladearealet for intermolekylære kræfter, hvilket resulterer i et lavere kogepunkt.
I resumé, mens isomerer deler den samme molekylære formel, fører deres forskellige strukturelle arrangementer til forskellige fysiske og kemiske egenskaber.
 Varme artikler
Varme artikler
-
 Indfanger adfærden af enkeltatom-katalysatorer på fartenEn ny undersøgelse kontrollerede præcist fastgørelsen af platinatomer (hvide kugler) til en titaniumdioxidoverflade (gitterværk af røde og blå kugler). Den fandt, at deres positioner varierede fra a
Indfanger adfærden af enkeltatom-katalysatorer på fartenEn ny undersøgelse kontrollerede præcist fastgørelsen af platinatomer (hvide kugler) til en titaniumdioxidoverflade (gitterværk af røde og blå kugler). Den fandt, at deres positioner varierede fra a -
 Ny cellulær billeddannelse baner vej for kræftbehandlingEt menneske, et enzym og nogle gelbånd - fluorescerende billeddannende midler visualiserer enzymaktivitet i sundt og sygt væv. Dette vil hjælpe med design og vurdering af mere effektive lægemidler mod
Ny cellulær billeddannelse baner vej for kræftbehandlingEt menneske, et enzym og nogle gelbånd - fluorescerende billeddannende midler visualiserer enzymaktivitet i sundt og sygt væv. Dette vil hjælpe med design og vurdering af mere effektive lægemidler mod -
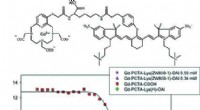 To-i-én kontrastmiddel til medicinsk billeddannelseKredit:Wiley Magnetisk resonansbilleddannelse (MRI) visualiserer indre kropsstrukturer, ofte ved hjælp af kontrastmidler for at øge følsomheden. Et belgisk hold af forskere har nu udviklet et bimo
To-i-én kontrastmiddel til medicinsk billeddannelseKredit:Wiley Magnetisk resonansbilleddannelse (MRI) visualiserer indre kropsstrukturer, ofte ved hjælp af kontrastmidler for at øge følsomheden. Et belgisk hold af forskere har nu udviklet et bimo -
 Forskere skaber syntetisk prototissue, der kan synkroniseresOpdagelsen, udgivet i Naturmaterialer , er den første kemisk programmerede tilgang til fremstilling af et kunstigt væv. Fundene, som kan have store sundhedsmæssige anvendelser i fremtiden, kunne se
Forskere skaber syntetisk prototissue, der kan synkroniseresOpdagelsen, udgivet i Naturmaterialer , er den første kemisk programmerede tilgang til fremstilling af et kunstigt væv. Fundene, som kan have store sundhedsmæssige anvendelser i fremtiden, kunne se
- Forskere afslører problemer med nuklear teori, observere ingen magisk adfærd ved N=32 laderadier a…
- Udslettede dyr i Amazonas Rainforest
- Europa er klar til at opsende atmosfære-sonderende satellit
- Hvilke erhverv beregner mekanisk energi?
- Hvis ikke i atmosfæren, hvor bliver kulstof så hen?
- Hvorfor iværksætteruddannelse mislykkes i fattige regioner


