Hvordan forklarer kinetisk teori kompressibiliteten af gas?
Nøglekoncepter:
* gaspartikler er bredt fordelt: Gasmolekyler er langt fra hinanden sammenlignet med deres størrelse. Dette betyder, at der er en masse tomme mellemrum mellem dem.
* Tilfældig bevægelse: Gasmolekyler bevæger sig tilfældigt og hurtigt og kolliderer konstant med hinanden og væggene i deres beholder.
* ubetydelige intermolekylære kræfter: Kræfterne til tiltrækning mellem gasmolekyler er svage, næsten ubetydelige sammenlignet med kræfterne til tiltrækning i væsker og faste stoffer.
Hvordan komprimerbarhed sker:
1. Anvendelse af pres: Når der påføres tryk på en gas, tvinges gasmolekylerne tættere sammen. Dette reducerer det tomme rum mellem dem.
2. øget kollisionshastighed: Den nærmere nærhed af molekylerne fører til en stigning i hyppigheden og kraften af kollisioner mellem dem og containervæggene.
3. Nedsat volumen: Den øgede kollisionshastighed resulterer i et fald i det volumen, der er optaget af gassen. Dette skyldes, at molekylerne effektivt presses ind i et mindre rum.
Kontrast med væsker og faste stoffer:
* væsker: Mens væsker også er komprimerbare, er deres kompressibilitet meget lavere end for gasser. Dette skyldes, at flydende molekyler er meget tættere sammen, hvilket efterlader mindre tom plads til at komprimere.
* faste stoffer: Faststoffer betragtes generelt som ukomprimerbare, fordi deres molekyler er tæt pakket og holdes i en stiv struktur.
Kortfattet:
Den kinetiske teori forklarer komprimerbarheden af gasser ved at fremhæve de store tomme rum mellem gasmolekyler og de svage kræfter i tiltrækning mellem dem. Påføring af tryk reducerer dette tomme rum, hvilket fører til øgede kollisioner og et fald i volumenet, der er optaget af gassen.
 Varme artikler
Varme artikler
-
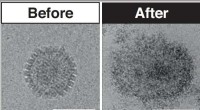 Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud.
Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud. -
 Undersøgelse afslører indsigt i enzym, der bekæmper en almindelig drivhusgasTre tilstande af modningsapparatet af N2 O-reduktase:Et kompleks af proteinerne NosF (gul), NosY (rød) og NosD (grøn) ændrer sin konformation ved at forbruge biokemisk energi og kan dermed overtage en
Undersøgelse afslører indsigt i enzym, der bekæmper en almindelig drivhusgasTre tilstande af modningsapparatet af N2 O-reduktase:Et kompleks af proteinerne NosF (gul), NosY (rød) og NosD (grøn) ændrer sin konformation ved at forbruge biokemisk energi og kan dermed overtage en -
 Uldlignende materiale kan huske og ændre formEt keratinark foldet til en kompleks origamistjerne som sin permanente form. Kredit:Luca Cera/Harvard SEAS Som enhver, der nogensinde har glattet deres hår, ved, vand er fjenden. Hår, der omhyggel
Uldlignende materiale kan huske og ændre formEt keratinark foldet til en kompleks origamistjerne som sin permanente form. Kredit:Luca Cera/Harvard SEAS Som enhver, der nogensinde har glattet deres hår, ved, vand er fjenden. Hår, der omhyggel -
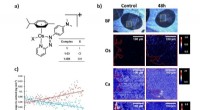 Røntgenfluorescenskortlægning for at måle tumorpenetration af et nyt anticancermiddelFigur 1:A) Struktur af FY26 og relaterede komplekser, [(ŋ6-p-cym)Os(Azpy-NMe2)X]+. B) Lysfeltbilleder og SXRF elementære kort over Os, Ca og Zn i A2780 humane ovariecarcinom sfæroide sektioner (500 nm
Røntgenfluorescenskortlægning for at måle tumorpenetration af et nyt anticancermiddelFigur 1:A) Struktur af FY26 og relaterede komplekser, [(ŋ6-p-cym)Os(Azpy-NMe2)X]+. B) Lysfeltbilleder og SXRF elementære kort over Os, Ca og Zn i A2780 humane ovariecarcinom sfæroide sektioner (500 nm


