Hvis 4,82 g af et ukendt stof opvarmes til 115 og DEGC, placeres derefter i 35,0 ml vand ved 28,7, hvilket opvarmes 34,5 DEGC. Bestem den specifikke varmekapacitet substat?
1. Forstå koncepterne
* Specifik varmekapacitet: Mængden af varmeenergi, der kræves for at hæve temperaturen på 1 gram af et stof med 1 grader Celsius (eller Kelvin).
* Varmeoverførsel: Varmeenergi strømmer fra et varmere objekt til et køligere objekt, indtil de når termisk ligevægt.
2. Opret ligningerne
Vi bruger følgende ligning til at beregne varmeoverførslen:
* q =mcΔt
Hvor:
* Q =varmeenergi overført (i joules)
* m =masse (i gram)
* C =specifik varmekapacitet (i J/G ° C)
* ΔT =ændring i temperatur (i ° C)
3. Beregn den varme, der er absorberet af vandet
* m_water =35,0 g (Forudsat at densiteten af vand er 1 g/ml)
* c_water =4.184 j/g ° C (Specifik varmekapacitet af vand)
* ΔT_Water =34,5 ° C
* q_water =m_water * c_water * ΔT_water
* q_water =(35,0 g) * (4,184 J/g ° C) * (34,5 ° C) =5045,7 J
4. Beregn den varme, der er mistet af det ukendte stof
* q_substance =-q_water (Da varmen mistet af stoffet er lig med varme opnået ved vandet)
* q_substance =-5045.7 J
5. Beregn stoffets specifikke varmekapacitet
* m_substance =4,82 g
* Δt_substance =(115 ° C - 28,7 ° C) =86,3 ° C
* q_substance =m_substance * c_substance * Δt_substance
* -5045,7 J =(4,82 g) * c_substance * (86,3 ° C)
* c_substance =-5045,7 J/(4,82 g * 86,3 ° C) =-1,21 J/g ° C
Vigtig note: Den specifikke varmekapacitet kan ikke være negativ. Dette indikerer, at der kan være en fejl i de givne oplysninger, eller vi har muligvis gået glip af et skridt i vores beregninger.
dobbeltkontrol dit arbejde
* Sørg for, at du har brugt de korrekte enheder gennem beregningerne.
* Gennemgå de oprindelige betingelser, og sørg for, at de er realistiske.
Hvis du stadig er usikker på resultatet, skal du give den originale kilde til problemet.
Sidste artikelHvad er NDRRMC eller NDRRO?
Næste artikelEr antallet af protoner inden for et atomelement lig med dets atomnummer?
 Varme artikler
Varme artikler
-
 Den bemærkelsesværdige variation af aktinide-tetrafluorid elektroniske strukturerActinide tetrafluorid pulvere af thorium, uran, neptunium, og plutonium viser en række farver, antydning af variabiliteten i deres elektroniske strukturer. Farveprøver vist her er mærket i henhold til
Den bemærkelsesværdige variation af aktinide-tetrafluorid elektroniske strukturerActinide tetrafluorid pulvere af thorium, uran, neptunium, og plutonium viser en række farver, antydning af variabiliteten i deres elektroniske strukturer. Farveprøver vist her er mærket i henhold til -
 Forskere finder stor lineær negativ termisk ekspansion i intermetalliske Cr-Se-Te-forbindelserTemperaturafhængighed af volumenændringer af Cr-Te-Se med forskellige sammensætninger. Kredit:ZHENG Xinqi Forskere brugte et røntgendiffraktometer (XRD) med variabel temperatur på Kinas Steady Hig
Forskere finder stor lineær negativ termisk ekspansion i intermetalliske Cr-Se-Te-forbindelserTemperaturafhængighed af volumenændringer af Cr-Te-Se med forskellige sammensætninger. Kredit:ZHENG Xinqi Forskere brugte et røntgendiffraktometer (XRD) med variabel temperatur på Kinas Steady Hig -
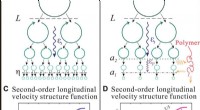 Eksperimentel observation af skalering af det elastiske område i turbulent flow med polymeradditive…Fysisk billede af den turbulente energikaskade og dens manifestation på andenordens longitudinelle hastighedsstrukturfunktion (VSF). (A og B) Tegnefilm, der viser det fysiske billede af energikaskaden
Eksperimentel observation af skalering af det elastiske område i turbulent flow med polymeradditive…Fysisk billede af den turbulente energikaskade og dens manifestation på andenordens longitudinelle hastighedsstrukturfunktion (VSF). (A og B) Tegnefilm, der viser det fysiske billede af energikaskaden -
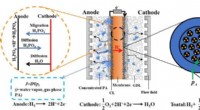 Forudsigelse af fordeling af phosphorsyre og vand i højtemperatur polymerelektrolytmembranbrændsel…Skematisk af katodekatalysatorlaget baseret på agglomerat-antagelsen. Kredit:Sun Mu Højtemperatur polymer elektrolytmembran brændselscelle (HT-PEMFC) kan anvendes i elektriske køretøjer og marine s
Forudsigelse af fordeling af phosphorsyre og vand i højtemperatur polymerelektrolytmembranbrændsel…Skematisk af katodekatalysatorlaget baseret på agglomerat-antagelsen. Kredit:Sun Mu Højtemperatur polymer elektrolytmembran brændselscelle (HT-PEMFC) kan anvendes i elektriske køretøjer og marine s
- Hvad er det mest almindelige molekyle i menneskets krop lavet af hvilket element?
- Hvad er 3 en halv liter i ml?
- Lava spreder sig mere end to miles fra den filippinske vulkan
- Undersøgelser tyder på, at silicium kunne være en fotonik-game-changer
- Hygrometer Uses
- Nyt silicabaseret adsorbent hjælper med selektiv adskillelse af strontium


