Hvad med følgende notationer er korrekt ædelgaskonfiguration for SR?
1. Find strontium på den periodiske tabel:
* Strontium er i periode 5, gruppe 2 (alkaliske jordmetaller).
2. Identificer den foregående ædelgas:
* Den ædle gas, der kommer før Strontium, er Krypton (KR), som er i periode 4.
3. Bestem de resterende elektroner:
* Strontium har et atomnummer på 38, hvilket betyder, at det har 38 elektroner.
* Krypton har et atomnummer på 36, hvilket betyder, at det har 36 elektroner.
* Dette betyder, at Strontium har 2 yderligere elektroner ud over Kryptons konfiguration.
4. Skriv den ædle gaskonfiguration:
* Den korrekte ædle gaskonfiguration for strontium er [KR] 5S² .
Derfor er det rigtige svar [KR] 5S².
Sidste artikelNår en syre reagerer med en base, hvad de gør?
Næste artikelHvor mange molekyler er der i kulilte?
 Varme artikler
Varme artikler
-
 Video:Hvordan blyanter kan hjælpe os med at forstå fremtiden for alting (Alex vil have en jetpack)Kredit:The American Chemical Society Kemiverdenen har været begejstret for muligheden for buckyballs, grafen og kulstofnanorør i årtier. Men videnskaben har taget lang tid at indhente hypen. Så
Video:Hvordan blyanter kan hjælpe os med at forstå fremtiden for alting (Alex vil have en jetpack)Kredit:The American Chemical Society Kemiverdenen har været begejstret for muligheden for buckyballs, grafen og kulstofnanorør i årtier. Men videnskaben har taget lang tid at indhente hypen. Så -
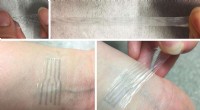 Ingeniører udvikler en plastelektrode, der strækker sig som gummi, men bærer elektricitet som led…Et trykt elektrodemønster af den nye polymer strækkes til flere gange af sin oprindelige længde (øverst), og en gennemsigtig, meget elastisk elektronisk hud -plaster, der danner en intim grænseflade m
Ingeniører udvikler en plastelektrode, der strækker sig som gummi, men bærer elektricitet som led…Et trykt elektrodemønster af den nye polymer strækkes til flere gange af sin oprindelige længde (øverst), og en gennemsigtig, meget elastisk elektronisk hud -plaster, der danner en intim grænseflade m -
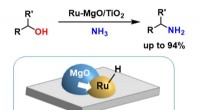 En forbedret ruthenium-baseret katalysator til primær aminsynteseDirekte aminering af alkoholer over Ru-MgO/TiO2 aktiveret ved elektrondonation fra MgO. Kredit:Yusuke Kita Forskere ved Tokyo Institute of Technology (Tokyo Tech) har udviklet en højtydende genanv
En forbedret ruthenium-baseret katalysator til primær aminsynteseDirekte aminering af alkoholer over Ru-MgO/TiO2 aktiveret ved elektrondonation fra MgO. Kredit:Yusuke Kita Forskere ved Tokyo Institute of Technology (Tokyo Tech) har udviklet en højtydende genanv -
 Den hurtige fremtid for smarte stofferPå dette billede af stof, du kan se det grønne lys af funktionelle fibre. Ingen menneskeskabte genstande er mere allestedsnærværende eller udsat for mere vitale data end det tøj, vi alle bærer, siger
Den hurtige fremtid for smarte stofferPå dette billede af stof, du kan se det grønne lys af funktionelle fibre. Ingen menneskeskabte genstande er mere allestedsnærværende eller udsat for mere vitale data end det tøj, vi alle bærer, siger
- Ingeniører undersøger, hvordan man kan forbedre højhastighedstogforbindelser mod frysning
- En undersøgelse fremhæver de afrikanske tilhørsforhold til den sydvestlige europæiske Acheulean
- At skabe attraktion mellem molekyler dybt i det periodiske system
- Orkanen Ida blev til et monster takket være en kæmpe varm plet i Den Mexicanske Golf
- Sådan fungerer det: Spændingsrelæ
- Hvordan DNA er bevaret i arkæologiske sedimenter i tusinder af år


