Hvad er reglerne for synteseaktion?
regler for synteseaktioner
Synteseaktioner er kemiske reaktioner, hvor to eller flere reaktanter kombineres for at danne et enkelt, mere komplekst produkt. Her er nogle generelle regler:
1. Reaktanter:
* to eller flere reaktanter kræves for en synteseaktion.
* Disse reaktanter kan være elementer eller forbindelser.
* Reaktanter skal være i deres enkleste former.
2. Produkt:
* et enkelt produkt dannes i en synteseaktion.
* Produktet er mere komplekst end reaktanterne, hvilket betyder, at det har et større antal atomer eller en mere kompleks struktur.
3. Energi:
* Energi frigives ofte I syntese -reaktioner, hvilket gør dem eksoterme. Dette skyldes, at dannelsen af nye obligationer frigiver energi.
* Imidlertid er nogle synteseaktioner endotermiske, hvilket kræver, at energiindgang forekommer.
4. Formel:
* Generel formel: A + B → AB
Eksempler på synteseaktioner:
* Dannelse af vand: 2H₂ + O₂ → 2H₂O
* Dannelse af natriumchlorid: 2na + cl₂ → 2naCl
* Dannelse af kuldioxid: C + O₂ → CO₂
* Dannelse af magnesiumoxid: 2 mg + o₂ → 2mgo
Vigtige noter:
* Synteseaktioner er også kendt som kombinationsreaktioner .
* Produkterne af synteseaktioner er normalt mere stabile end reaktanterne på grund af dannelsen af stærkere bindinger.
* afbalancering af kemiske ligninger er vigtig for nøjagtigt at repræsentere synteseaktioner. Dette sikrer det samme antal atomer i hvert element på begge sider af ligningen.
ud over det grundlæggende:
* De specifikke betingelser (temperatur, tryk, katalysatorer), der kræves til en bestemt synteseaktion, kan variere markant.
* Nogle synteseaktioner involverer flere trin og kan være ret komplekse.
* Produkterne fra en synteseaktion kan reageres yderligere i andre kemiske reaktioner, hvilket fører til dannelse af endnu mere komplekse molekyler.
At forstå de generelle regler for synteseaktioner giver et fundament for forståelse og forudsigelse af kemiske reaktioner. Ved at anvende disse regler kan du begynde at dechiffrere den komplekse kemiverden.
Sidste artikelHvad plejede at desinficere vand?
Næste artikelHvilket kemi -princip styrer nedbørreaktionen?
 Varme artikler
Varme artikler
-
 En stabil kobberkatalysator til omdannelse af kuldioxidKredit:CC0 Public Domain En ny katalysator til omdannelse af kuldioxid (CO 2 ) til kemikalier eller brændstoffer er blevet udviklet af forskere ved Ruhr-Universität Bochum og University of Duisb
En stabil kobberkatalysator til omdannelse af kuldioxidKredit:CC0 Public Domain En ny katalysator til omdannelse af kuldioxid (CO 2 ) til kemikalier eller brændstoffer er blevet udviklet af forskere ved Ruhr-Universität Bochum og University of Duisb -
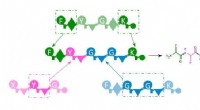 Nye aktive ingredienser fra værktøjskassenSkematisk diagram af værktøjskassesystemet af NRPS-enzymer til produktion af nye aktive ingredienser. Fragmenter fra naturlige systemer (grøn, magenta, blå) samles igen i en ny rækkefølge (midten) og
Nye aktive ingredienser fra værktøjskassenSkematisk diagram af værktøjskassesystemet af NRPS-enzymer til produktion af nye aktive ingredienser. Fragmenter fra naturlige systemer (grøn, magenta, blå) samles igen i en ny rækkefølge (midten) og -
 Forskere udvikler den kemi, der er nødvendig for at skabe et alkometer til marihuanaLegaliseringen og afkriminaliseringen af marihuana i Californien og andre steder har gjort afsløring af marihuana særlig vigtig, sagde seniorforfatter Neil Garg. Kredit:Jesse Herring UCLA-kemike
Forskere udvikler den kemi, der er nødvendig for at skabe et alkometer til marihuanaLegaliseringen og afkriminaliseringen af marihuana i Californien og andre steder har gjort afsløring af marihuana særlig vigtig, sagde seniorforfatter Neil Garg. Kredit:Jesse Herring UCLA-kemike -
 Dyrkning af mikrovæv til erstatning for dyreforsøgVed at bruge princippet om litografi, en infrarød laser skriver præcise strukturer ind i matricen. Cellerne vokser efter den specificerede plan. Dette åbner nye muligheder for generering af tredimensi
Dyrkning af mikrovæv til erstatning for dyreforsøgVed at bruge princippet om litografi, en infrarød laser skriver præcise strukturer ind i matricen. Cellerne vokser efter den specificerede plan. Dette åbner nye muligheder for generering af tredimensi
- Sortering af det sociale netværk fakers fra movers og shakers
- Ny statistisk metode forbinder enorme optegnelser, viser negativ effekt af Texas vælger-id-lov
- Efter Facebook-undersøgelse, er Google den næste?
- Hvordan globale faktorer påvirker Thailands gummimarked
- Fremstilling af snoede halvledere til 3D-projektion
- Hvordan maskingeværet revolutionerede krigsførelse


