En ægte gas adskiller sig fra et ideal, fordi molekylerne af har?
Her er en sammenbrud af hvorfor:
* Ideelle gasforudsætninger: Ideel gasteori antager, at gasmolekyler ikke har nogen volumen og ikke interagerer med hinanden. Dette forenkler beregninger, men er ikke helt nøjagtige i scenarier i den virkelige verden.
* Ægte gasvolumen: Rigtige gasmolekyler, selvom de er meget små, besætter et begrænset volumen. Dette betyder, at den plads, der er tilgængelig for dem til at bevæge sig rundt, er lidt mindre end den samlede volumen af beholderen.
* Intermolekylære kræfter: Ægte gasmolekyler tiltrækker hinanden, især ved højere tryk og lavere temperaturer. Disse attraktive kræfter, som van der Waals -styrker, får molekylerne til at afvige fra den ideelle gasadfærd, hvor de antages at være uafhængige.
Kortfattet: De endelige volumen og intermolekylære kræfter af reelle gasmolekyler forårsager afvigelser fra den ideelle gaslov, især ved høje tryk og lave temperaturer.
 Varme artikler
Varme artikler
-
 Nye resultater muliggør overvågning for skadelige toksiner i ferskvandsmiljøerMikroskopbillede af den guanitoksin-producerende cyanobakterie Sphaerospermopsis torques-reginae. Kredit:Vera Regina Werner Et internationalt hold af forskere har identificeret de gener og den bios
Nye resultater muliggør overvågning for skadelige toksiner i ferskvandsmiljøerMikroskopbillede af den guanitoksin-producerende cyanobakterie Sphaerospermopsis torques-reginae. Kredit:Vera Regina Werner Et internationalt hold af forskere har identificeret de gener og den bios -
 Ny miljøvenlig elektrokemisk reaktion kan syntetisere nyttige halvledermaterialerElektrokemisk opsætning til syntese af thienoacenderivater. Kredit:Okayama University 2020 Organiske solceller har en række anvendelser inden for elektronik, især i udviklingen af nye elektronis
Ny miljøvenlig elektrokemisk reaktion kan syntetisere nyttige halvledermaterialerElektrokemisk opsætning til syntese af thienoacenderivater. Kredit:Okayama University 2020 Organiske solceller har en række anvendelser inden for elektronik, især i udviklingen af nye elektronis -
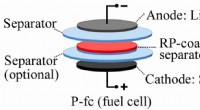 Bedre rød end frygt:Barrieren holder batterierne sikreEt lag rødt fosfor i genopladelige litiummetalbatterier kan signalere, når skadelige dendritter truer med at skabe en kortslutning. Teknikken udviklet på Rice University kunne føre til mere kraftfulde
Bedre rød end frygt:Barrieren holder batterierne sikreEt lag rødt fosfor i genopladelige litiummetalbatterier kan signalere, når skadelige dendritter truer med at skabe en kortslutning. Teknikken udviklet på Rice University kunne føre til mere kraftfulde -
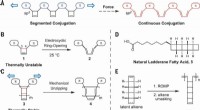 Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B)
Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B)
- Er klubsoda en homogen eller en heterogen blanding?
- Hvorfor bliver Al pan kedelig, når den ikke bruges?
- Regelfølgende molekyler giver den første direkte bekræftelse af en halvt århundrede gammel teori
- Kunne 'The Day After Tomorrow' ske?
- Hvordan gjorde en meteor hundredvis af mennesker syge?
- Den faste syre opløses i 100 ml deioniseret vand efterfulgt af 10 ethanol. Hvordan påvirker dette …


