Er CR og CU den samme atomradius?
Her er hvorfor:
* atomnummer: Krom har et atomnummer på 24, mens kobber har et atomnummer på 29. Dette betyder, at kobber har flere protoner og elektroner end krom.
* Elektronkonfiguration: De ekstra elektroner i kobber fylder et højere energiniveau (3D -skal) sammenlignet med krom. Denne øgede elektronafskærmning fra de indre skaller får de yderste elektroner i kobber til at opleve en svagere tiltrækning til kernen, hvilket fører til en større atomradius.
* Tendenser i den periodiske tabel: I en periode i den periodiske tabel falder atomradius generelt på grund af øget atomafgift og et stærkere træk på elektronerne. Denne tendens forstærkes yderligere ved tilsætning af elektroner til det samme energiniveau i kobber.
Kortfattet: Kobber har en større atomradius end krom på grund af det større antal elektroner og det højere energiniveau for dets yderste elektroner.
 Varme artikler
Varme artikler
-
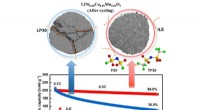 Ny kombination af materialer skaber rekordstore lithium-metalcellerDen ioniske flydende elektrolyt ILE (højre) forhindrer stort set strukturelle ændringer på den nikkelrige NCM88 katode. Efter 1000 cykler, batterikapacitet når stadig 88 procent. Kredit:Fanglin Wu og
Ny kombination af materialer skaber rekordstore lithium-metalcellerDen ioniske flydende elektrolyt ILE (højre) forhindrer stort set strukturelle ændringer på den nikkelrige NCM88 katode. Efter 1000 cykler, batterikapacitet når stadig 88 procent. Kredit:Fanglin Wu og -
 Forskere afslører skjult katalytisk overflade af Ni-Au kerneskal i kuldioxidhydrogenering1a) In situ TEM -billedserier; fig. Ib) katalytisk ydeevne; 1c) skematisk illustration Kredit:LIU Wei Årevis, kerne-skal strukturerede partikler er blevet anerkendt som veldesignede katalysatorer,
Forskere afslører skjult katalytisk overflade af Ni-Au kerneskal i kuldioxidhydrogenering1a) In situ TEM -billedserier; fig. Ib) katalytisk ydeevne; 1c) skematisk illustration Kredit:LIU Wei Årevis, kerne-skal strukturerede partikler er blevet anerkendt som veldesignede katalysatorer, -
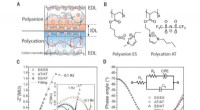 Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in
Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in -
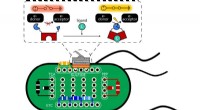 Switch-in-a-celle elektrificerer livetRice University forskere brugte E coli bakterier som en platform til at teste proteinkontakter, der kan bruges til at kontrollere strømmen af elektroner. Proteiner placeret i celler kan simpelthen
Switch-in-a-celle elektrificerer livetRice University forskere brugte E coli bakterier som en platform til at teste proteinkontakter, der kan bruges til at kontrollere strømmen af elektroner. Proteiner placeret i celler kan simpelthen
- Hvad bruges til at beskrive betingelserne for en reaktionsligevægt?
- Sydkorea forbyder bjørneopdræt, men hvad gør man med hundredvis af tilbageværende dyr i fangensk…
- Robust Bain-forvrængning i premartensitfasen af en platinsubstitueret Ni2MnGa
- Forskere arbejder på at bringe Biscayne Bay tilbage fra randen
- Anvendelsen af NPN Transistorer
- Hvordan kan jordens tekstur påvirke et fundament?


