Hvilke er de mulige produkter fra en enkelt erstatningsreaktion?
Hvad er en enkelt erstatningsreaktion?
En enkelt erstatningsreaktion (også kaldet en enkelt forskydningsreaktion) opstår, når et element erstatter et andet i en forbindelse. Den generelle form er:
* A + BC → AC + B
Hvor:
* a Er det enkelte element erstatning for et andet element.
* bc er forbindelsen.
* ac er den nye forbindelse dannet.
* b er det element, der bliver forskudt.
mulige produkter
Produkterne fra en enkelt erstatningsreaktion afhænger af reaktiviteten af de involverede elementer. Der er to hovedmuligheder:
1. en ny forbindelse og et gratis element:
* Dette sker, når element a er mere reaktiv end element b . Element A vil fortrænge b Fra forbindelsen, danner en ny forbindelse og forlader b som et gratis element.
* Eksempel:
* zn (s) + cuso₄ (aq) → znso₄ (aq) + cu (s)
* Zink (Zn) er mere reaktiv end kobber (Cu), så det fortrænger kobber fra kobbersulfat, danner zinksulfat og fast kobber.
2. Ingen reaktion:
* Dette sker, når element a er mindre reaktiv end element b . I dette tilfælde element a vil ikke være i stand til at fortrænge b fra forbindelsen.
* Eksempel:
* cu (s) + Znso₄ (aq) → Ingen reaktion
* Kobber (Cu) er mindre reaktiv end zink (Zn), så det kan ikke fortrænge zink fra zinksulfat.
nøglepunkter at huske:
* Aktivitetsserie: For at forudsige, om en enkelt erstatningsreaktion vil forekomme, skal du konsultere aktivitetsserien med metaller eller ikke -metaller. Denne serie rangerer elementer fra de fleste til mindst reaktive. Et mere reaktivt element vil fortrænge et mindre reaktivt element.
* Typer af enkeltudskiftningsreaktioner:
* metalforskydning: Et metal erstatter et andet metal i en forbindelse (eksempel:zinkudskiftning af kobber i det første eksempel ovenfor).
* Ikke -metalfortrængning: En ikke -metal erstatter en anden ikke -metal i en forbindelse (eksempel:klorudskiftning af brom i en forbindelse).
* afbalanceringsligninger: Husk altid at afbalancere den kemiske ligning efter at have forudsagt produkterne.
Fortæl mig, hvis du gerne vil udforske specifikke eksempler eller have flere detaljer om reaktiviteten af metaller eller ikke -metaller!
 Varme artikler
Varme artikler
-
 Forskere baner vejen for store, effektive organiske solceller med vandbehandlingOrganiske solceller (OSCer) udviser mange ønskværdige egenskaber, herunder en høj konverteringseffektivitet og nem skalerbarhed. Det har imidlertid vist sig udfordrende at kontrollere morfologien af
Forskere baner vejen for store, effektive organiske solceller med vandbehandlingOrganiske solceller (OSCer) udviser mange ønskværdige egenskaber, herunder en høj konverteringseffektivitet og nem skalerbarhed. Det har imidlertid vist sig udfordrende at kontrollere morfologien af -
 Ny undersøgelse undersøger effektiviteten af atomaffaldsfilter i nanoskalaVed at knytte et nitrogenholdigt molekyle til MOFerne, vores kolleger viste, at de kunne fange disse radioaktive molekyler meget effektivt, ” sagde Dr. Kui Tan, en UT Dallas forsker. Kredit:University
Ny undersøgelse undersøger effektiviteten af atomaffaldsfilter i nanoskalaVed at knytte et nitrogenholdigt molekyle til MOFerne, vores kolleger viste, at de kunne fange disse radioaktive molekyler meget effektivt, ” sagde Dr. Kui Tan, en UT Dallas forsker. Kredit:University -
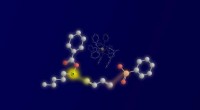 Forskere bruger ketylradikaler til en ny flerkomponentreaktionDe tre reaktanter og deres binding:radikal af ketyltypen til venstre, 1,3-dien i midten og nukleofil sulfinat til højre. De reaktive atomer og bindingen, der dannes, er fremhævet med gult (ketylkulsto
Forskere bruger ketylradikaler til en ny flerkomponentreaktionDe tre reaktanter og deres binding:radikal af ketyltypen til venstre, 1,3-dien i midten og nukleofil sulfinat til højre. De reaktive atomer og bindingen, der dannes, er fremhævet med gult (ketylkulsto -
 Bakterier fra varme kilder løser stofskiftets mysteriumBakterierne Thermus thermophilus lever i varme kilder. Kredit:Peter Brzezinski Forbrænding er ofte en hurtig proces, som i tilfælde af brand. Hvordan kan celler kontrollere brændingsprocessen så g
Bakterier fra varme kilder løser stofskiftets mysteriumBakterierne Thermus thermophilus lever i varme kilder. Kredit:Peter Brzezinski Forbrænding er ofte en hurtig proces, som i tilfælde af brand. Hvordan kan celler kontrollere brændingsprocessen så g
- Forskning afslører, hvorfor nogle aktier bliver ved med at vinde, mens andre taber
- En opskalering af nanoporøs membrancentrifuge til afsaltning af omvendt osmose uden tilsmudsning
- Betragtes H2 som en polær binding?
- Bekæmpelse af listeria og andre fødevarebårne sygdomme med nanobioteknologi
- Forskere opdager en hurtigere måde at fremstille vaskulære materialer på
- Hvem opdagede Super Atom eller Bec?


