Hvad er binære forbindelser, der indeholder to ikke -metaller?
Her er nogle nøglefunktioner:
* lavet af to ikke -metale elementer: Disse forbindelser består af atomer fra to forskellige elementer, der begge findes på højre side af den periodiske tabel (ekskl. Brint). Eksempler inkluderer ilt, klor, nitrogen, kulstof, svovl og fosfor.
* dannet ved at dele elektroner: Ikke -metallerbinding ved at dele elektroner og danne kovalente bindinger. Denne deling skaber et mere stabilt arrangement af elektroner for begge involverede atomer.
* findes ofte som molekyler: Kovalente forbindelser findes typisk som diskrete molekyler snarere end som et kontinuerligt netværk af ioner som ioniske forbindelser.
* navngivning følger specifikke regler: Navngivningen af disse forbindelser adskiller sig fra ioniske forbindelser. Generelt er elementet, der først er anført, den længere til venstre på den periodiske tabel, eller hvis de er i den samme kolonne, den ene nedre nede. Det andet elements navn slutter i "-ide." Præfikser bruges til at indikere antallet af hvert tilstedeværende atom (mono-, di-, tri-, tetra- osv.).
Eksempler:
* CO2 - Kuldioxid (et kulstof, to ilt)
* SO2 - Svovldioxid (et svovl, to ilt)
* n2o - Dinitrogen -monoxid (to nitrogen, et ilt)
* pcl3 - Fosfor trichlorid (et fosfor, tre klor)
* NO2 - Kvælstofdioxid (et nitrogen, to ilt)
Nøglepunkt: Mens reglerne for navngivning af kovalente forbindelser generelt følger mønsteret beskrevet ovenfor, er der undtagelser og almindelige navne for nogle forbindelser.
 Varme artikler
Varme artikler
-
 Hvad hvis vi kunne designe kraftfulde lægemidler uden uønskede bivirkninger?Kredit:CC0 Public Domain Psykedelika såsom LSD og magiske svampe har vist sig meget effektive til behandling af depression og posttraumatiske stresslidelser, men medicinsk brug af disse stoffer er
Hvad hvis vi kunne designe kraftfulde lægemidler uden uønskede bivirkninger?Kredit:CC0 Public Domain Psykedelika såsom LSD og magiske svampe har vist sig meget effektive til behandling af depression og posttraumatiske stresslidelser, men medicinsk brug af disse stoffer er -
 Forskere laver bæredygtig polymer af sukkerarter i træDen nye polymer er fremstillet ved hjælp af xylose, et sukker, der findes i træ. Kredit:Leszek Kobusinski Forskere fra University of Bath har lavet en bæredygtig polymer ved at bruge det næstmest
Forskere laver bæredygtig polymer af sukkerarter i træDen nye polymer er fremstillet ved hjælp af xylose, et sukker, der findes i træ. Kredit:Leszek Kobusinski Forskere fra University of Bath har lavet en bæredygtig polymer ved at bruge det næstmest -
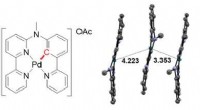 Lys og nanopartikler mod kræftFigur 1. Kemisk formel (til venstre) og Pd ... Pd -interaktion (til højre) i krystalstrukturen i Zhous nye palladiumkompleks. Kredit:Leiden University Leiden Ph.D. studerende Xuequan Zhou har desi
Lys og nanopartikler mod kræftFigur 1. Kemisk formel (til venstre) og Pd ... Pd -interaktion (til højre) i krystalstrukturen i Zhous nye palladiumkompleks. Kredit:Leiden University Leiden Ph.D. studerende Xuequan Zhou har desi -
 Ny NMR-teknik tilbyder molekylært vindue til levende organismerProfessor Andre Simpson har udviklet en ny NMR-teknik, der kan få en højopløselig profil af, hvilke molekyler der er til stede inde i en levende organisme. Kredit:Ken Jones En ny teknik udviklet a
Ny NMR-teknik tilbyder molekylært vindue til levende organismerProfessor Andre Simpson har udviklet en ny NMR-teknik, der kan få en højopløselig profil af, hvilke molekyler der er til stede inde i en levende organisme. Kredit:Ken Jones En ny teknik udviklet a
- Har Celestron Nexstar 8Se Telescope Ultimate Package brug for en computer, og i bekræftende fald kr…
- Jernbane, hvordan våben virker
- Hvad hedder masser af nervevæv?
- Ledere slutter sig til Frances Macron for at diskutere klimakrisen
- Hvordan påvirkede hydraulisk minedrift miljøet?
- Hvordan eksklusiv 'laser shock peening'-teknologi forbedrer flyets pålidelighed og levetid


