Hvorfor er alle atomnumre hele, og de fleste massetal ender med en decimaler?
atomnummer:
* repræsenterer protoner: Atomnummeret definerer et element og er lig med antallet af protoner i dets kerne.
* Protoner er grundlæggende partikler: Protoner er diskrete, hvilket betyder, at de findes som hele enheder. Du kan ikke have en halv proton.
* elementer defineres af protoner: Hvert element har et unikt antal protoner. Ændring af antallet af protoner ændrer elementet helt.
atommasse:
* repræsenterer gennemsnitlig vægt: Atommassen er den gennemsnitlige masse af alle isotoper i et element.
* isotoper har forskellige neutroner: Isotoper af det samme element har det samme antal protoner, men forskellige antal neutroner.
* neutroner bidrager til masse: Neutroner har som protoner masse.
* Gennemsnitlig vægt: Den atommasse, du ser på den periodiske tabel, er et vægtet gennemsnit af masserne af alle isotoper i dette element under hensyntagen til deres relative overflod i naturen. Denne gennemsnitsproces resulterer ofte i et decimaltal.
Eksempel:
Overvej klor (CL).
* atomnummer: 17 (hvilket betyder, at det har 17 protoner)
* isotoper: Chlor har to hovedisotoper:chlor-35 (17 protoner og 18 neutroner) og klor-37 (17 protoner og 20 neutroner).
* atommasse: Atommassen af klor er cirka 35,45. Dette skyldes, at klor-35 er mere rigelig end klor-37, så dens masse bidrager mere til det samlede gennemsnit.
Key Takeaway: Atomnumre er hele tal, fordi de repræsenterer antallet af protoner, som er grundlæggende partikler. Atommasser er ofte decimaler, fordi de repræsenterer det vægtede gennemsnit af masserne af alle isotoper af et element under hensyntagen til deres forskellige neutronantal og forekomst.
 Varme artikler
Varme artikler
-
 Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn
Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn -
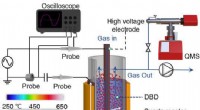 Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the
Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the -
 Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat
Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat -
 Cellehænder for at låse døre op inden for sundhedsforskning, lægemiddeldesign, og bioingeniørSyndecan -4 forbinder cellen inde med rummet udenfor - en førsteklasses position til at kommunikere inde og ude signaler. Kredit:3DforScience - Visuals for Bio &Health, Imperial College London Pro
Cellehænder for at låse døre op inden for sundhedsforskning, lægemiddeldesign, og bioingeniørSyndecan -4 forbinder cellen inde med rummet udenfor - en førsteklasses position til at kommunikere inde og ude signaler. Kredit:3DforScience - Visuals for Bio &Health, Imperial College London Pro
- En elektronisk afstembar metaoverflade, der roterer polarisering
- Schweizisk politi efterforsker dødsulykke brand, der involverer Tesla
- Forbedret overholdelse af den fælles landbrugspolitik med offentligt tilgængelige og brugergenerer…
- Cyberangreb mod den tyske regering fortsætter
- Hvad har geografisk distribution at gøre med evolution?
- Phonon-katalyse kan føre til et nyt felt


