Hvorfor har alle gruppe 1 -elementer elektron på den ydre skal?
* Elektronkonfiguration: Gruppe 1 -elementer er kendt som alkalimetaller. De har alle et elektron i deres yderste energiniveau (også kendt som Valence Shell). Dette skyldes, at deres elektronkonfiguration ender med *ns¹ *, hvor "N" repræsenterer det vigtigste kvantetal. For eksempel:
* lithium (Li): 1S² 2S¹
* natrium (NA): 1S² 2S² 2P⁶ 3S¹
* kalium (k): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S¹
* reaktivitet: Denne enkelt valenselektron holdes meget løst og taber let, hvilket gør gruppe 1 -elementer ekstremt reaktive. De danner let ioniske forbindelser ved at donere dette elektron til dannelse af kationer med en +1 ladning.
Nøglepunkter:
* Antallet af elektroner i den ydre skal bestemmer et elements kemiske reaktivitet og bindingsadfærd.
* Gruppe 1 -elementer har kun et elektron i deres yderste skal, hvilket gør dem meget reaktive.
* Denne enkelt valenselektron er ansvarlig for deres karakteristiske egenskaber, som deres tendens til at danne ioniske forbindelser og deres lave ioniseringsenergier.
Sidste artikelHvordan er du valance s plus hno3 er lig med SO2 NO2 H2O?
Næste artikelHvilke strejker planeter og måner er lavet af klipper?
 Varme artikler
Varme artikler
-
 Fysikere får ny indsigt i nanosystemer med sfærisk indeslutningBipolær struktur samlet af stive polymerer ved lave tætheder. Kredit:Arash Nikoubashman, Mainz Universitet Teoretiske fysikere ledet af professor Kurt Binder og Dr. Arash Nikoubashman ved Johannes
Fysikere får ny indsigt i nanosystemer med sfærisk indeslutningBipolær struktur samlet af stive polymerer ved lave tætheder. Kredit:Arash Nikoubashman, Mainz Universitet Teoretiske fysikere ledet af professor Kurt Binder og Dr. Arash Nikoubashman ved Johannes -
 Ny belægning bringer lithiummetalbatteri tættere på virkelighedenHovedforfattere og ph.d. studerende David Mackanic, venstre, og Zhiao Yu med deres batteritester til højre. Yu holder et fad med allerede testede celler, som de kalder batterikirkegården. Kredit:Mark
Ny belægning bringer lithiummetalbatteri tættere på virkelighedenHovedforfattere og ph.d. studerende David Mackanic, venstre, og Zhiao Yu med deres batteritester til højre. Yu holder et fad med allerede testede celler, som de kalder batterikirkegården. Kredit:Mark -
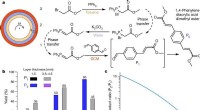 En ny måde at automatisere sekvenser af kemiske reaktionerFlertrins organiske synteser i koncentriske væskereaktorer. Kredit: Natur (2020). DOI:10.1038/s41586-020-2768-9 Et team af forskere fra Ulsan National Institute of Science and Technology i Korea
En ny måde at automatisere sekvenser af kemiske reaktionerFlertrins organiske synteser i koncentriske væskereaktorer. Kredit: Natur (2020). DOI:10.1038/s41586-020-2768-9 Et team af forskere fra Ulsan National Institute of Science and Technology i Korea -
 Samarbejde giver lovende innovation inden for pletbestandighedPrøver af klud både ubehandlet, venstre, og behandlet med en fluor-fri oleofob belægning udviklet i laboratorier af Emmanuel Giannelis, professor i materialevidenskab og teknik, og Jintu Fan, professo
Samarbejde giver lovende innovation inden for pletbestandighedPrøver af klud både ubehandlet, venstre, og behandlet med en fluor-fri oleofob belægning udviklet i laboratorier af Emmanuel Giannelis, professor i materialevidenskab og teknik, og Jintu Fan, professo
- Tætte stjernehobe kan fremme sorte huls megafusioner
- En ny undersøgelse giver en vigtig forståelse af, hvordan molekylære motorproteiner er involveret…
- Fakta om Seaweed
- Blue Origin forsinker næste fly på grund af tekniske problemer
- Dyrs mitokondrierforsvar opdaget i planter
- Ny nanoteknologi vil muliggøre en sund elektrisk strømproduktion inde i menneskekroppen


