Hvad er carbon-12 og carbon-14?
Her er en sammenbrud af hver:
carbon-12 (¹²c)
* atomnummer: 6 (hvilket betyder, at det har 6 protoner)
* Massenummer: 12 (hvilket betyder, at det har 6 protoner + 6 neutroner)
* overflod: ~ 98,9% af alt kulstof på jorden
* stabilitet: Stabil isotop
* Brug: Grundlaget for atommasseenheden (AMU)
carbon-14 (¹⁴c)
* atomnummer: 6 (hvilket betyder, at det har 6 protoner)
* Massenummer: 14 (hvilket betyder, at det har 6 protoner + 8 neutroner)
* overflod: Sporbeløb (ca. 1 del pr. Billion)
* stabilitet: Radioaktiv isotop med en halveringstid på 5.730 år
* Brug:
* radiocarbon -datering: Forskere bruger forfaldet af carbon-14 til at bestemme alderen for gamle artefakter og fossiler.
* sporing af biologiske processer: Carbon-14 bruges til at spore bevægelsen af kulstof gennem levende organismer.
Nøgleforskelle:
* Antal neutroner: Carbon-14 har yderligere to neutroner end carbon-12.
* stabilitet: Carbon-12 er stabil, mens Carbon-14 er radioaktiv og nedbrydes over tid.
* overflod: Carbon-12 er meget mere rigelig end carbon-14.
* applikationer: Carbon-12 er standarden for atommasse, mens carbon-14 bruges til datering og sporing.
I det væsentlige, mens begge isotoper er kulstof, giver deres forskellige neutrontællinger dem unikke egenskaber, der gør dem nyttige inden for forskellige videnskabelige felter.
Sidste artikelHvor mange protoner neutroner og elektroner er i kulstof 6?
Næste artikelHvor mange protoner er der i C-12-isotoperne?
 Varme artikler
Varme artikler
-
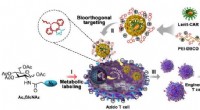 Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR-
Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR- -
 Forskerholdet sigter mod at reducere omkostningerne ved lægemiddeludvikling ved hjælp af 3-D-print…Dr. Thomas E. Angelini i UF Soft Matter Research Lab. Kredit:Herbert Wertheim College of Engineering Thomas E. Angelini, Ph.D., Lektor i Institut for Mekanisk &Luftfartsteknik ved University of Fl
Forskerholdet sigter mod at reducere omkostningerne ved lægemiddeludvikling ved hjælp af 3-D-print…Dr. Thomas E. Angelini i UF Soft Matter Research Lab. Kredit:Herbert Wertheim College of Engineering Thomas E. Angelini, Ph.D., Lektor i Institut for Mekanisk &Luftfartsteknik ved University of Fl -
 Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA
Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA -
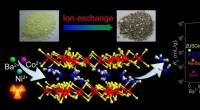 Selektiv indfangning af ioner fra spildevand med lagdelt metalsulfidSelektiv fangst af Ba 2 + , Ni 2 + , og Co 2 + af en robust lagdelt metalsulfid. Kredit:Prof. FENG Det er vigtigt at udvikle kemisk selektive rensemidler for ioner såsom Ba 2 + , N
Selektiv indfangning af ioner fra spildevand med lagdelt metalsulfidSelektiv fangst af Ba 2 + , Ni 2 + , og Co 2 + af en robust lagdelt metalsulfid. Kredit:Prof. FENG Det er vigtigt at udvikle kemisk selektive rensemidler for ioner såsom Ba 2 + , N
- Hvordan aktiverer nematodeinfektion planteforsvarsrespons i sojaplanter?
- At tale med os selv:Hvordan forbrugere navigerer i valg og indre konflikter
- Supernova-rest W49B undersøgt med XMM-Newton
- Hvad er petrologi studiet af?
- Vil farvestoffer påvirke vandfordampningshastigheden?
- Hvordan adskiller man pulver fra vand?


