Hvad ville være volumenet i liter på 85,5 gram kulilte ved?
Hvorfor temperatur og trykstof
Mængden af en gas er direkte relateret til dens temperatur og tryk. Her er hvordan:
* Temperatur: Når temperaturen på en gas øges, bevæger molekylerne sig hurtigere og spreder sig, hvilket øger volumenet.
* tryk: Når trykket på en gas øges, presses molekylerne tættere sammen, hvilket reducerer volumenet.
Brug af den ideelle gaslov
Den ideelle gaslov er den mest almindelige måde at relatere volumen, tryk, temperatur og mængde af en gas. Det udtrykkes som:
pv =nrt
Hvor:
* p =Pres (i atmosfærer, ATM)
* v =Volumen (i liter, l)
* n =Antal mol (mol)
* r =Ideal gaskonstant (0,0821 L · ATM/Mol · K)
* t =Temperatur (i Kelvin, K)
Her er hvordan man løser problemet:
1. Beregn antallet af mol (n) af CO:
* Find den molære masse af CO (12,01 g/mol til C + 16,00 g/mol til O =28,01 g/mol)
* Opdel massen af CO med den molære masse:
* n =85,5 g / 28,01 g / mol =3,05 mol
2. skal du tilvejebringe temperaturen (t) og tryk (p) på kuliloxidgassen.
3. Løs for volumen (v):
* Omarranger den ideelle gaslov:V =(NRT) / P
* Tilslut værdierne for N, R, T og P.
Eksempel:
Lad os sige, at temperaturen er 25 ° C (298 K), og trykket er 1 atm.
* V =(3,05 mol * 0,0821 L · atm / mol · K * 298 K) / 1 atm
* V ≈ 75,2 L
Derfor er volumenet på 85,5 gram kulilte ved 25 ° C og 1 atm ca. 75,2 liter.
Vigtig note: Husk at altid medtage temperaturen og trykket, når du spørger om volumenet af en gas.
 Varme artikler
Varme artikler
-
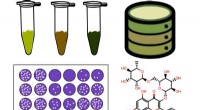 Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch
Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch -
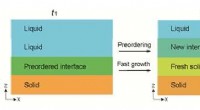 Domino-lignende krystallisering af glasKredit:University of Tokyo Materialer i en glasagtig tilstand er overalt i vores liv og har bidraget til menneskeheden i mange år. I dag, de spiller en afgørende rolle i forskellige teknologier, h
Domino-lignende krystallisering af glasKredit:University of Tokyo Materialer i en glasagtig tilstand er overalt i vores liv og har bidraget til menneskeheden i mange år. I dag, de spiller en afgørende rolle i forskellige teknologier, h -
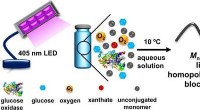 Ultrahøje præcisionspolymererKredit: Angewandte Chemie En miljøvenlig og bæredygtig syntese af tunge polymerer med meget snævre molekylvægtfordelinger er et vigtigt begreb i moderne polymerkemi. Takket være en ny fotoenzymat
Ultrahøje præcisionspolymererKredit: Angewandte Chemie En miljøvenlig og bæredygtig syntese af tunge polymerer med meget snævre molekylvægtfordelinger er et vigtigt begreb i moderne polymerkemi. Takket være en ny fotoenzymat -
 Forskning i retning af levedygtige, sikre batterier overvinder høj modstand, solid-state barrierer …Kredit:A. James Clark School of Engineering, University of Maryland Ingeniører ved University of Maryland har udviklet et middel til at overvinde forhindringer i udviklingen af solid-state batte
Forskning i retning af levedygtige, sikre batterier overvinder høj modstand, solid-state barrierer …Kredit:A. James Clark School of Engineering, University of Maryland Ingeniører ved University of Maryland har udviklet et middel til at overvinde forhindringer i udviklingen af solid-state batte
- Naturinspireret grøn energiteknologi rydder vigtig udviklingshindring
- Hvad sker der med solen, når den løber tør for brint?
- Forskere finder en billigere måde at oplyse OLED-skærme på
- Hvor længe har en stjerne størrelsen på din sol brug for at modne til voksenhætte?
- Sådan bruges ammetre
- Amazon åbner nye forposter i New York, det nordlige Virginia


