Hvilke egenskaber har alle ikke -metaller til fælles?
Fysiske egenskaber:
* Dårlige ledere af varme og elektricitet: De modstår strømmen af varme og elektricitet, hvilket gør dem til gode isolatorer.
* sprød: De har en tendens til at bryde let snarere end bøjning eller deform.
* kedeligt udseende: De mangler den skinnende glans, der er karakteristisk for metaller.
* gasser eller væsker ved stuetemperatur: De fleste ikke -metaller findes som gasser (som ilt og nitrogen) eller væsker (som brom), mens kun nogle få er faste stoffer (som svovl og kulstof).
* lav densitet: De er generelt mindre tætte end metaller.
Kemiske egenskaber:
* Høj elektronegativitet: De har en tendens til at tiltrække elektroner i kemiske bindinger.
* Få elektroner let: De danner anioner (negativt ladede ioner), når de reagerer med metaller.
* Form kovalente obligationer: De deler typisk elektroner med andre ikke -metaller til dannelse af molekyler.
* reagerer med metaller for at danne salte: For eksempel reagerer natrium (et metal) med klor (et ikke -metal) for at danne bordsalt (NaCI).
* findes i forskellige stater: De findes i forskellige former som diatomiske molekyler (som O2), polyatomiske molekyler (som CO2) og netværk (som diamant).
Undtagelser:
Det er vigtigt at bemærke, at selvom disse egenskaber er almindelige for de fleste ikke -metaller, er der nogle undtagelser. For eksempel er grafit (en form for kulstof) en god leder af elektricitet.
Eksempler på ikke -metaller:
* Oxygen (O)
* Nitrogen (n)
* Kulstof (c)
* Svovl (r)
* Fosfor (P)
* Klor (CL)
* Brom (BR)
* Jod (i)
Disse delte egenskaber gør ikke -metaller adskilt fra metaller og spiller en vigtig rolle i deres kemiske opførsel og applikationer.
Sidste artikelHvad er 4 typer kemisk vejrforhold?
Næste artikelHvad bruges flyve til?
 Varme artikler
Varme artikler
-
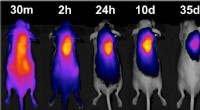 Et hyppelys for kemoterapilægemidlerHos mus, en hydrogel rekrutterer et farvestoffemærket molekyle (farvede områder) til sin placering, viser dets potentiale til at være et hjemfyrtårn for kræftmedicin. Kredit:Tilpasset fra ACS Central
Et hyppelys for kemoterapilægemidlerHos mus, en hydrogel rekrutterer et farvestoffemærket molekyle (farvede områder) til sin placering, viser dets potentiale til at være et hjemfyrtårn for kræftmedicin. Kredit:Tilpasset fra ACS Central -
 Forskere designer et enzym til at syntetisere kulhydraterKredit:Universidad de Barcelona Sukker- eller kulhydratsyntese er vigtig for udviklingen af diagnostiske tests, vacciner og nye lægemidler. I en samarbejdsundersøgelse, forskere har syntetiseret
Forskere designer et enzym til at syntetisere kulhydraterKredit:Universidad de Barcelona Sukker- eller kulhydratsyntese er vigtig for udviklingen af diagnostiske tests, vacciner og nye lægemidler. I en samarbejdsundersøgelse, forskere har syntetiseret -
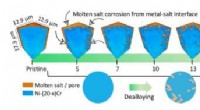 Forskere ser smeltede salte skære små kroge og tunneler ind i metallegeringer i 3DIllustrationen viser, hvordan smeltet salt over tid fjerner metallisk materiale (blå) fra prøven i 3D (øvre) og 2D -visualiseringer (nedre). Denne proces, såkaldt dealloying skaber et bikontinuerligt
Forskere ser smeltede salte skære små kroge og tunneler ind i metallegeringer i 3DIllustrationen viser, hvordan smeltet salt over tid fjerner metallisk materiale (blå) fra prøven i 3D (øvre) og 2D -visualiseringer (nedre). Denne proces, såkaldt dealloying skaber et bikontinuerligt -
 Algoritmer og lasere tæmmer kemisk reaktivitetKredit:CC0 Public Domain Forskere har udviklet en algoritme til fotokemi, bringer det spirende felt et skridt nærmere målet om at bruge forskellige lysfarver som en kontakt til at aktivere en rækk
Algoritmer og lasere tæmmer kemisk reaktivitetKredit:CC0 Public Domain Forskere har udviklet en algoritme til fotokemi, bringer det spirende felt et skridt nærmere målet om at bruge forskellige lysfarver som en kontakt til at aktivere en rækk


