Hvordan kan smeltepunktet af vand ændres?
1. Tryk:
* Øget pres: Anvendelse af tryk på vandet faktisk * sænker * dets smeltepunkt. Dette skyldes, at højtrykket favoriserer den tættere faste fase (ICE). Dette er grunden til, at skøjter fungerer - trykket fra bladet smelter et tyndt lag af is, så skøjten kan glide.
* Nedsat pres: Sænkning af trykket * hæver * smeltepunktet. Dette er grunden til, at vand koger ved en lavere temperatur i høje højder, hvor det atmosfæriske tryk er lavere.
2. Urenheder:
* opløste salte: Tilsætning af salt til vand sænker sit frysepunkt. Derfor salt vi veje om vinteren for at forhindre dannelse af is.
* Andre opløste stoffer: Andre opløste stoffer kan også påvirke frysepunktet, skønt effekten ofte er mindre dramatisk end med salte.
3. Opløste gasser:
* opløste gasser: Gasser, der er opløst i vand, kan ændre smeltepunktet lidt, hvilket normalt sænker det.
4. Isotoper:
* deuterium: Tungt vand, der indeholder deuterium (en isotop af brint), har et lidt højere smeltepunkt end almindeligt vand.
5. Elektriske og magnetiske felter:
* elektriske og magnetiske felter: Selvom det ikke er en almindelig forekomst, kan ekstremt stærke elektriske og magnetiske felter påvirke smeltepunktet for vand.
Det er vigtigt at bemærke:
* små ændringer: Vandets smeltepunkt er ganske følsomt over for ændringer i tryk, men andre faktorer har typisk en mindre effekt.
* Virkelige applikationer: Disse effekter har praktiske konsekvenser, såsom brugen af frostvæske i bilradiatorer og bevarelse af mad ved frysning.
Fortæl mig, hvis du gerne vil udforske nogen af disse faktorer mere detaljeret!
Sidste artikelHvordan adskiller du vandmel og kugler?
Næste artikelHvorfor betragtes alkymi som en gammel form for kemi?
 Varme artikler
Varme artikler
-
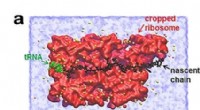 Mekanisk kraft styrer proteinsyntesens hastighedForskere opdagede, at proteiner, repræsenteret ved den sorte linje, udøver en mekanisk kraft, når de forlader den molekylære maskine, hvor de syntetiseres, repræsenteret med rødt. Denne kraft moderere
Mekanisk kraft styrer proteinsyntesens hastighedForskere opdagede, at proteiner, repræsenteret ved den sorte linje, udøver en mekanisk kraft, når de forlader den molekylære maskine, hvor de syntetiseres, repræsenteret med rødt. Denne kraft moderere -
 Kvantefysik og origami for det ultimative komme godt-kortMetal nanopartikel koncept kunst. Kredit:Prof. Eden Morales-Narváez, CIO Mexico Papirbaserede diagnostiske tests er billige, praktisk og biologisk nedbrydelig. Imidlertid, deres anvendelse er begr
Kvantefysik og origami for det ultimative komme godt-kortMetal nanopartikel koncept kunst. Kredit:Prof. Eden Morales-Narváez, CIO Mexico Papirbaserede diagnostiske tests er billige, praktisk og biologisk nedbrydelig. Imidlertid, deres anvendelse er begr -
 Syntetiske veje gør planter til biofabrikker for nye molekylerKredit:CC0 Public Domain Planter kan producere en bred vifte af molekyler, hvoraf mange hjælper dem med at bekæmpe skadelige skadedyr og patogener. Biologer har udnyttet denne evne til at producer
Syntetiske veje gør planter til biofabrikker for nye molekylerKredit:CC0 Public Domain Planter kan producere en bred vifte af molekyler, hvoraf mange hjælper dem med at bekæmpe skadelige skadedyr og patogener. Biologer har udnyttet denne evne til at producer -
 Ekspanderende polymer muliggør selvfoldende printbare strukturer uden opvarmning eller nedsænkning…En ny metode producerer en printbar struktur, der begynder at folde sig selv sammen, så snart den er pillet af printplatformen. Kredit:Massachusetts Institute of Technology Da 3D-print er blevet e
Ekspanderende polymer muliggør selvfoldende printbare strukturer uden opvarmning eller nedsænkning…En ny metode producerer en printbar struktur, der begynder at folde sig selv sammen, så snart den er pillet af printplatformen. Kredit:Massachusetts Institute of Technology Da 3D-print er blevet e
- Behandling af leverkræft med mikrorobotter styret af et magnetfelt
- Matematik som våben mod ørkenspredning
- Ind i det molekylære øje:Undersøgelse af flydende prøver i realtid
- Hvorfor drejer et radiometer, når der blinker lys på det?
- Måling af malstrømmen:Hvordan sedimenter bevæger sig og sætter sig under stærke strømningshæn…
- Hydrologisk tørke forstærker naturbrande i fugtige troper i Borneos


