Hvad er kraften mellem SO2 -molekyler?
Her er en sammenbrud af de typer van der Waals -styrker, der er til stede i SO2:
* London Dispersion Forces: Disse er til stede i alle molekyler, uanset polaritet. De stammer fra midlertidige udsving i elektronfordeling og skaber midlertidige dipoler, der inducerer dipoler i nabolande molekyler.
* dipol-dipolinteraktioner: SO2 er et polært molekyle på grund af dets bøjede molekylære geometri og forskellen i elektronegativitet mellem svovl og ilt. Dette permanente dipolmoment fører til attraktive kræfter mellem molekyler med modsatte ladninger.
* Hydrogenbinding: Mens SO2 ikke har brint direkte bundet til et stærkt elektronegativt atom som ilt, kan det stadig deltage i svage hydrogenbindingsinteraktioner. Dette forekommer på grund af tilstedeværelsen af ensomme par på iltatomerne, som kan danne svage hydrogenbindinger med hydrogenatomer fra andre SO2 -molekyler.
Nøglepunkter:
* Van der Waals -kræfter er relativt svage sammenlignet med ioniske eller kovalente bindinger.
* Styrken af disse kræfter øges med stigende molekylær størrelse og polariserbarhed.
* Den polære karakter af SO2 bidrager til dens intermolekylære kræfter, hvilket gør den til en væske ved stuetemperatur.
Sammenfattende er kræfterne mellem SO2 -molekyler overvejende van der Waals Forces , inklusive London-spredningskræfter, dipol-dipol-interaktioner og svag brintbinding. Disse kræfter bidrager til de fysiske egenskaber ved SO2, såsom dets smeltepunkt, kogepunkt og opløselighed.
Sidste artikelHvilken kraft er der mellem SO2 -molekyle?
Næste artikelI hvilket atmosfærelag opholder 80 procent af gassen sig?
 Varme artikler
Varme artikler
-
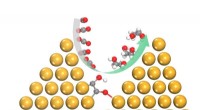 Super-selektive katalysatorer er nøglen til kulstofomdannelseDen unikke rumlige indeslutning induceret af kobbernanopyramider er afgørende for selektivt at generere ethylenglycol gennem en ny reaktionsvej. Kredit:Shizhang Qiao, Universitetet i Adelaide Kata
Super-selektive katalysatorer er nøglen til kulstofomdannelseDen unikke rumlige indeslutning induceret af kobbernanopyramider er afgørende for selektivt at generere ethylenglycol gennem en ny reaktionsvej. Kredit:Shizhang Qiao, Universitetet i Adelaide Kata -
 At møde en 100 år gammel udfordring kan føre vejen til digitale aromaerLugte kan måles ved deres afstand fra hinanden. Kredit:Weizmann Institute of Science Dufte – der lover mystik og intriger – blandes af mesterparfumører, deres opskrifter holdt hemmelige. I en ny u
At møde en 100 år gammel udfordring kan føre vejen til digitale aromaerLugte kan måles ved deres afstand fra hinanden. Kredit:Weizmann Institute of Science Dufte – der lover mystik og intriger – blandes af mesterparfumører, deres opskrifter holdt hemmelige. I en ny u -
 Eksperimentel undersøgelse af, hvordan metalglas former, udfordrer paradigme inden for glasforsknin…Metalliske briller som produceret i Lab på Saarland University. Kredit:Gallino/Busch Medmindre du tilfældigvis er en materialeforsker, hvilket de fleste af os trods alt ikke er, udtrykket briller
Eksperimentel undersøgelse af, hvordan metalglas former, udfordrer paradigme inden for glasforsknin…Metalliske briller som produceret i Lab på Saarland University. Kredit:Gallino/Busch Medmindre du tilfældigvis er en materialeforsker, hvilket de fleste af os trods alt ikke er, udtrykket briller -
 Glimmer giver et fingerpeg om, hvordan vand transporterer mineralerForskere ved Argonne så på dynamikken i transporten af visse elementer - især rubidium - ved grænsefladen mellem vand og glimmer, et fladt gennemsigtigt mineral afbilledet ovenfor. Kredit:Beth Harve
Glimmer giver et fingerpeg om, hvordan vand transporterer mineralerForskere ved Argonne så på dynamikken i transporten af visse elementer - især rubidium - ved grænsefladen mellem vand og glimmer, et fladt gennemsigtigt mineral afbilledet ovenfor. Kredit:Beth Harve
- Seismisk kort over Nordamerika afslører geologiske spor, fare for jordskælv
- Hvordan indtog forhistoriske mennesker det tibetanske plateau?
- Forskere foreslår et blockchain -datanetværk for at øge produktionen
- COVID-19 er en unik mulighed for at bevæge sig mod et mere bæredygtigt og retfærdigt samfund
- Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…
- Hvordan spredes antibiotikaresistens? Forskere finder svar i næsen


