Hvad er reaktionen fra NaCl Plus iskoldt vand?
* opløsning: NaCl-krystallerne går i stykker i individuel natrium (Na+) og chlorid (Cl-) ioner. Disse ioner bliver omgivet af vandmolekyler og danner en hydreret opløsning.
* endotermisk proces: Opløsning af NaCl i vand er en endotermisk proces, hvilket betyder, at den absorberer varme fra omgivelserne. Dette er grunden til at tilføje salt til is kan hjælpe med at smelte isen.
Den samlede reaktion kan repræsenteres som:
NaCl (S) + H₂O (L) → NA⁺ (AQ) + CL⁻ (AQ)
nøglepunkter at huske:
* opløselighed: NaCl er meget opløselig i vand, hvilket betyder, at den let opløses.
* Temperatur: Opløseligheden af NaCl øges med temperaturen. Selv i iskoldt vand opløses imidlertid en betydelig mængde salt stadig.
* smeltning af is: Den endotermiske karakter af opløsning af salt får de omgivende vandmolekyler til at absorbere varme, hvilket kan hjælpe med at smelte isen. Dette er princippet bag brug af salt på iskolde veje.
Fortæl mig, hvis du har yderligere spørgsmål!
 Varme artikler
Varme artikler
-
 Hvorfor tandpasta og cement hærder over tidUniversity of Delaware kemisk og biomolekylær ingeniørprofessor og formand Eric Furst og et team af forskere fra Ecole des Ponts og University Paris-Est i Frankrig har opdaget en proces kaldet kontakt
Hvorfor tandpasta og cement hærder over tidUniversity of Delaware kemisk og biomolekylær ingeniørprofessor og formand Eric Furst og et team af forskere fra Ecole des Ponts og University Paris-Est i Frankrig har opdaget en proces kaldet kontakt -
 Forskere opdager en effektiv og bæredygtig måde at filtrere salt- og metalioner fra vand påKredit:CC0 Public Domain Med to milliarder mennesker verden over mangler adgang til rent og sikkert drikkevand, fælles forskning fra Monash University, CSIRO og University of Texas i Austin offent
Forskere opdager en effektiv og bæredygtig måde at filtrere salt- og metalioner fra vand påKredit:CC0 Public Domain Med to milliarder mennesker verden over mangler adgang til rent og sikkert drikkevand, fælles forskning fra Monash University, CSIRO og University of Texas i Austin offent -
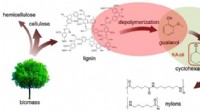 Ny proces gør papirfremstillingsaffald til værdifulde kemikalierKredit:Ames Laboratory En gruppe forskere ved U.S. Department of Energys Ames Laboratory har opdaget en måde at konvertere et fælles biprodukt af papirfremstillingsprocessen til værdifulde kemiske
Ny proces gør papirfremstillingsaffald til værdifulde kemikalierKredit:Ames Laboratory En gruppe forskere ved U.S. Department of Energys Ames Laboratory har opdaget en måde at konvertere et fælles biprodukt af papirfremstillingsprocessen til værdifulde kemiske -
 Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri
Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri
- Fluorholdige molekyler fra cellekulturer
- Hvordan er tyngdekraften relateret til massen af to genstande, der interagerer og afstand mellem t…
- Hvilke fordele giver cellevægge planteceller, der kontakter frisk vand?
- En efterligning af godt kolesterol kunne en dag behandle hjerte-kar-sygdomme og andre sygdomme
- Taber valget? Hvem skal man bebrejde?
- Quantum dot solcellevinduer bliver ikke-giftige, farveløs, med rekordeffektivitet


