Hvilke forbindelser har sandsynligvis ikke ioniske bindinger?
1. Forbindelser dannet mellem ikke -metaller:
* Årsag: Ikke -metaller har generelt lignende elektronegativiteter. Dette betyder, at de har en lignende tendens til at tiltrække elektroner. Når to ikke -metalsbindinger, er forskellen i elektronegativitet ikke stor nok til at resultere i en komplet overførsel af elektroner, hvilket er nødvendigt for en ionisk binding. I stedet deler de elektroner til dannelse af kovalente bindinger.
* Eksempler:
* CO2 (kuldioxid)
* H2O (vand)
* NH3 (ammoniak)
* CL2 (klorgas)
* CH4 (metan)
2. Forbindelser med lav elektronegativitetsforskelle:
* Årsag: Ioniske bindinger dannes, når der er en signifikant forskel i elektronegativitet mellem to atomer, typisk mellem et metal og et ikke -metal. Når elektronegativitetsforskellen er lille, vil bindingen være mere kovalent.
* Eksempler:
* PCL3 (fosfor trichlorid) - Mens fosfor er en ikke -metal, har det en relativt lav elektronegativitet sammenlignet med klor.
* Hej (hydrogeniodid) - Mens jod er en ikke -metal, har det en lavere elektronegativitet end den stærkt elektronegative fluor, klor og brom.
3. Forbindelser med høje smelte- og kogepunkter:
* Årsag: Ioniske forbindelser har typisk høje smelte- og kogepunkter på grund af de stærke elektrostatiske kræfter mellem ionerne. Hvis en forbindelse har et relativt lavt smeltepunkt, er det mindre sandsynligt, at det er ionisk.
* Eksempler:
* Mange organiske forbindelser, som ethanol (CH3CH2OH) og acetone (CH3COCH3)
Vigtig note:
* polære kovalente obligationer: Nogle forbindelser har bindinger, der betragtes som "polære kovalente", hvilket betyder, at elektronerne deles ujævnt. Disse bindinger kan have en vis ionisk karakter, men den samlede binding forbliver stort set kovalente.
Fortæl mig, hvis du gerne vil have flere eksempler eller vil udforske specifikke forbindelser!
Sidste artikelHoldes en forbindelse sammen med modsatte afgifter?
Næste artikelHvad mangler alle uorganiske forbindelser?
 Varme artikler
Varme artikler
-
 Afkodning af strukturen og egenskaberne af nær-infrarøde reflekterende pigmenterI en ny undersøgelse bruger forskere fra Nagoya Institute of Technology, Japan en kombination af eksperimentelle og teoretiske tilgange til at forstå de optiske, elektroniske og magnetiske egenskaber
Afkodning af strukturen og egenskaberne af nær-infrarøde reflekterende pigmenterI en ny undersøgelse bruger forskere fra Nagoya Institute of Technology, Japan en kombination af eksperimentelle og teoretiske tilgange til at forstå de optiske, elektroniske og magnetiske egenskaber -
 Kul afslører en sofistikeret side:Beskidt kulstof kan bruges til at lave en række nyttige enhederInfrarødt (varme) billede viser en varmeanordning lavet af dampknækket tjære, udglødet med laser, som blev formet til et MIT-logo for at demonstrere processens kontrollerbarhed. Kredit:Massachusetts I
Kul afslører en sofistikeret side:Beskidt kulstof kan bruges til at lave en række nyttige enhederInfrarødt (varme) billede viser en varmeanordning lavet af dampknækket tjære, udglødet med laser, som blev formet til et MIT-logo for at demonstrere processens kontrollerbarhed. Kredit:Massachusetts I -
 Forskere foreslår en ny metode til storskala produktion af termisk stabile enkeltatomkatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. Qiao Botao fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi har foreslået en ny metode til storskala pro
Forskere foreslår en ny metode til storskala produktion af termisk stabile enkeltatomkatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. Qiao Botao fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi har foreslået en ny metode til storskala pro -
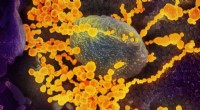 Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un
Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un
- SNS afslutter fuld neutronproduktionscyklus på rekordhøjt effektniveau
- Sådan beregnes opløselighed fra KSP
- 'Entrepreneurial spirit':Et produkt af naturen eller næring?
- Hvad er et ord, der betyder kærlighed til naturen?
- Forskere skaber nanofiber-gusher
- Kan lande stoppe overfiskeri og plastikforurening på kun 10 år?


