Hvad er varme af neutralisering NH4OH og CH3COOH?
1. Reaktionen:
NH 4 Åh (aq) + ch 3 COOH (aq) → CH 3 COO - (aq) + nh 4 + (aq) + h 2 O (l)
2. Forståelse af koncepterne:
* svag base og svag syre: NH 4 Åh er en svag base og ch 3 COOH er en svag syre. Dette betyder, at de ikke helt ioniserer i opløsningen.
* Neutraliseringsvarme: Neutraliseringsvarmen for en svag syre-svage baseaktion er generelt lavere end for en stærk syre-stærk baseaktion, fordi de svage arter ikke ioniserer fuldt ud.
* Eksperimentel bestemmelse: Bestemmelse af neutraliseringsvarmen for denne reaktion ville kræve et eksperiment, der involverer kalorimetri.
3. Tilnærmelse af neutraliseringsvarmen:
Da neutraliseringsvarmen for svage syrer og baser kan være varierende, kan vi tilnærme den ved hjælp af følgende information:
* stærk syre-stærk base: Neutraliseringsvarmen for en stærk syre -stærk baseaktion er ca. -57,1 kJ/mol.
* svag syre-svagt base: Neutraliseringsvarmen for en svag syre -svage baseaktion vil være mindre end -57,1 kJ/mol, men det er vanskeligt at forudsige den nøjagtige værdi uden eksperimentelle data.
Derfor neutraliseringsvarmen til reaktionen af NH 4 Åh og ch 3 COOH vil være mindre end -57,1 kJ/mol, men det er ikke muligt at give en præcis værdi uden eksperimentel bestemmelse.
Nøglepunkter:
* Neutraliseringsvarmen afhænger af den anvendte specifikke syre og base.
* Eksperimentelle målinger er nødvendige for nøjagtige værdier.
* Neutraliseringsvarmen for svage syrer og baser er generelt lavere end for stærke syrer og baser.
 Varme artikler
Varme artikler
-
 Ny letvægtsmetal lige så formbar som aluminiumplade med 1,5 gange højere styrkeSammenligning af nyudviklede og konventionelle magnesiumlegeringsplader efter at de har været udsat for Erichsen-tests. Kredit:National Institute for Materials Science Et forskerhold ved NIMS og N
Ny letvægtsmetal lige så formbar som aluminiumplade med 1,5 gange højere styrkeSammenligning af nyudviklede og konventionelle magnesiumlegeringsplader efter at de har været udsat for Erichsen-tests. Kredit:National Institute for Materials Science Et forskerhold ved NIMS og N -
 Materiale til ny generation atomreaktorer udvikletKredit:National University of Science and Technology MISIS Materialeforskere fra National University of Science and Technology MISIS (NUST MISIS) udviklede et unikt sandwich-stål-vanadium-stål mat
Materiale til ny generation atomreaktorer udvikletKredit:National University of Science and Technology MISIS Materialeforskere fra National University of Science and Technology MISIS (NUST MISIS) udviklede et unikt sandwich-stål-vanadium-stål mat -
 Ny metode til fremstilling af prækursorer til højstyrke kulfiberforarbejdningDet kan bruges til at producere kulfiber med nye forbedrede egenskaber. Kredit:Lobachevsky University Kulfiber er et vigtigt strukturelt materiale. På grund af sin høje styrke, i kombination med l
Ny metode til fremstilling af prækursorer til højstyrke kulfiberforarbejdningDet kan bruges til at producere kulfiber med nye forbedrede egenskaber. Kredit:Lobachevsky University Kulfiber er et vigtigt strukturelt materiale. På grund af sin høje styrke, i kombination med l -
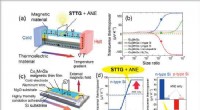 Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s
Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s
- Astronomer opdager radiohalo i en massiv galaksehob
- Reduktion af svovldioxidemissioner alene kan ikke reducere luftforureningen væsentligt
- Vega raketopsendelser fra Fransk Guyana
- Hvad er ældste datter syndrom? Er det en reel tilstand?
- Legender om de tabte reservoirer
- Hvad er forskellen mellem syntese og nedbrydningsreaktioner?


