Vil zink- og kobbersulfatopløsning reagere?
Her er hvorfor og hvad der sker:
* zink er mere reaktiv end kobber. Dette betyder, at zink har en stærkere tendens til at miste elektroner og danne positive ioner.
* kobbersulfatopløsning indeholder kobberioner (Cu²⁺) og sulfationer (SO₄²⁻).
* Når zink anbringes i kobbersulfatopløsningen, fortrænger zinkatomerne kobberionerne fra opløsningen. Zinkatomer mister elektroner til dannelse af zinkioner (Zn²⁺), og kobberionerne får elektroner til dannelse af kobberatomer (Cu).
Den kemiske ligning for denne reaktion er:
Zn (s) + cuso₄ (aq) → Znso₄ (aq) + cu (s)
Her er hvad du observerer:
* Et rødbrunt fast stof dannes på overfladen af zink. Dette er det kobber, der forskydes fra opløsningen.
* den blå farve på kobbersulfatopløsningen falder gradvist. Dette skyldes, at kobberionerne fjernes fra opløsningen.
I resuméet reagerer zink- og kobbersulfatopløsning på dannelse af zinksulfatopløsning og kobbermetal. Denne reaktion demonstrerer metallers relative reaktivitet.
Sidste artikelDet meste af kemi kan forstås ved hjælp af?
Næste artikelHvad er den korrekte forbindelse til CR2O3?
 Varme artikler
Varme artikler
-
 Svampe, fjer kombineres i biologisk nedbrydelige skoTo University of Delaware-studerende har lavet en biologisk nedbrydelig sko ved hjælp af svampe, kyllingefjer og tekstilaffald. Prototypeskoen består af en myceliumbaseret sål, dækket med vegansk læde
Svampe, fjer kombineres i biologisk nedbrydelige skoTo University of Delaware-studerende har lavet en biologisk nedbrydelig sko ved hjælp af svampe, kyllingefjer og tekstilaffald. Prototypeskoen består af en myceliumbaseret sål, dækket med vegansk læde -
 Gør mere plast genanvendeligtDIMOP-projektet har til formål at udvikle digitale værktøjer til nemt at bestemme og forbedre genanvendeligheden af plastprodukter, for eksempel, ved at reducere antallet af materialekomponenter. Kr
Gør mere plast genanvendeligtDIMOP-projektet har til formål at udvikle digitale værktøjer til nemt at bestemme og forbedre genanvendeligheden af plastprodukter, for eksempel, ved at reducere antallet af materialekomponenter. Kr -
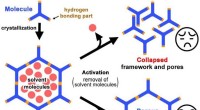 Porøse materialer kaster lys over miljørensningFigur 1. Skematisk fremstilling af porøse rammer konstrueret af brintmolekyler. Rammerne skal være stabile, selv efter fjernelse af opløsningsmiddelmolekyler fra porerne. Kredit:Osaka University I
Porøse materialer kaster lys over miljørensningFigur 1. Skematisk fremstilling af porøse rammer konstrueret af brintmolekyler. Rammerne skal være stabile, selv efter fjernelse af opløsningsmiddelmolekyler fra porerne. Kredit:Osaka University I -
 Cellekemi oplyst af laserlysRaman mikrospektroskopi hjælper forskere med at observere cellekemi ved at fokusere en laserstråle på et sted i en celle og derefter fange lys udsendt efter interaktioner med cellulære molekyler, som
Cellekemi oplyst af laserlysRaman mikrospektroskopi hjælper forskere med at observere cellekemi ved at fokusere en laserstråle på et sted i en celle og derefter fange lys udsendt efter interaktioner med cellulære molekyler, som
- Hvilke celler udgør epitelvævet?
- Hvordan ændres bevægelsesligninger for et objekt, der bevæger sig i ensartet bevægelse?
- Sådan oprettes en fuld adder med MultiMedia Logic
- Stejle klipper er udskåret af hvad?
- Hvordan beskytter troposfæren og stratospheren os?
- Nyt materiale har den højeste elektronmobilitet blandt kendte lagdelte magnetiske materialer


