Ville en stærk elektrolyt indeholde for det meste ioner molekyler af kombination begge dele?
* stærke elektrolytter: Dette er stoffer, der fuldstændigt adskiller sig (opdeles fra hinanden) i ioner, når de blev opløst i vand. Dette betyder, at når du tilsætter en stærk elektrolyt til vand, adskilles den i det væsentlige i dens bestanddele.
* ioner: Disse er ladede partikler, der kan udføre elektricitet. Den frie bevægelse af ioner i en opløsning er det, der gør opløsningen ledende.
* molekyler: Dette er neutrale grupper af atomer, der holdes sammen af kemiske bindinger. Mens nogle molekyler kan blive ioner, når de opløses, findes der primært stærke elektrolytter som ioner i opløsning.
Eksempler på stærke elektrolytter:
* salte: Natriumchlorid (NaCl) adskiller sig i Na+ og Cl- ioner i vand.
* Stærke syrer: Hydrochlorsyre (HCI) dissocieres i H+ og Cl- ioner i vand.
* Stærke baser: Natriumhydroxid (NaOH) dissocieres i Na+ og OH-ioner i vand.
Kortfattet: Stærke elektrolytter er kendetegnet ved deres komplette dissociation i ioner, når de opløses i vand, hvilket fører til løsninger, der er fremragende ledere af elektricitet.
 Varme artikler
Varme artikler
-
 Forskning lodder de molekylære byggesten til lysfølsomme materialerKredit:tanleimages/Shutterstock At skabe den næste generation af solceller og sensorer kræver et nøje kig på, hvordan lys interagerer med lysfølsomme materialer. Forskning ved U.S. Department of E
Forskning lodder de molekylære byggesten til lysfølsomme materialerKredit:tanleimages/Shutterstock At skabe den næste generation af solceller og sensorer kræver et nøje kig på, hvordan lys interagerer med lysfølsomme materialer. Forskning ved U.S. Department of E -
 Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så
Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så -
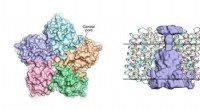 Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb
Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb -
 Ammoniaksyntese - den største innovation i det 20. århundredeTilpasning af de innovationstrin, der er involveret i ammoniaksyntese. Kredit:A. Barona et al./ Sci. Eng. Etik (fotos fra Archiv der Max-Planck-Gesellschaft, Berlin Udover at være et velkendt reng
Ammoniaksyntese - den største innovation i det 20. århundredeTilpasning af de innovationstrin, der er involveret i ammoniaksyntese. Kredit:A. Barona et al./ Sci. Eng. Etik (fotos fra Archiv der Max-Planck-Gesellschaft, Berlin Udover at være et velkendt reng


