Hvor mange valenselektroner har borgruppen?
Her er hvorfor:
* valenselektroner er elektronerne i den yderste skal af et atom, der er involveret i kemisk binding.
* gruppe 13 Elementer har alle deres yderste elektronkonfiguration som ns² np¹ .
For eksempel:
* bor (b): 1S² 2S² 2P¹ (3 Valenselektroner)
* aluminium (AL): 1S² 2S² 2P⁶ 3S² 3P¹ (3 Valenselektroner)
* gallium (GA): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P¹ (3 Valenselektroner)
* indium (in): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5P¹ (3 Valenselektroner)
* thallium (tl): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5P⁶ 6S² 4F¹⁴ 5D¹⁰ 6P¹ (3 Valence Electrons)
Sidste artikelHvad gør en automatiseret kemianalysator?
Næste artikelHvad er den endelige afbalancerede ligning C3H8 plus O2-CO2 H2O?
 Varme artikler
Varme artikler
-
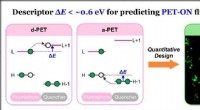 Generel beskrivelse sætter gang i fremskridt inden for farvestofkemiForskere fra SUTD, DICP, og POSTECH udviklede en teoretisk deskriptor ΔE til at forudsige PET-baserede fluorescensprober; ved at bruge denne deskriptor, de designede kvantitativt fluorescerende plette
Generel beskrivelse sætter gang i fremskridt inden for farvestofkemiForskere fra SUTD, DICP, og POSTECH udviklede en teoretisk deskriptor ΔE til at forudsige PET-baserede fluorescensprober; ved at bruge denne deskriptor, de designede kvantitativt fluorescerende plette -
 Byggesten i alt liv får ny forståelseKredit:CC0 Public Domain Ny forskning i et enzym, der er essentielt for fotosyntese og alt liv på jorden, har afsløret et nøglefund i dets struktur, som afslører, hvordan lys kan interagere med st
Byggesten i alt liv får ny forståelseKredit:CC0 Public Domain Ny forskning i et enzym, der er essentielt for fotosyntese og alt liv på jorden, har afsløret et nøglefund i dets struktur, som afslører, hvordan lys kan interagere med st -
 Meget stabil vandelektrolysekatalysator til produktion af brint og oxygenSkematisk diagram over foreslåede gebyroverførselsprocesser mellem MoSe 2 og LSC. Kredit:UNIST En nylig undersøgelse, tilknyttet UNIST har præsenteret ædle katalysatorer til vandelektrolyse, i s
Meget stabil vandelektrolysekatalysator til produktion af brint og oxygenSkematisk diagram over foreslåede gebyroverførselsprocesser mellem MoSe 2 og LSC. Kredit:UNIST En nylig undersøgelse, tilknyttet UNIST har præsenteret ædle katalysatorer til vandelektrolyse, i s -
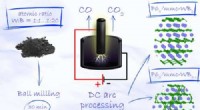 Superhård materialesyntese gjort billigereGrafisk abstrakt. Kredit:Uorganisk kemi (2022). DOI:10.1021/acs.inorgchem.1c03880 Skoltech-forskere og deres kolleger fra Tomsk Polytechnic University har foreslået en effektiv og billig måde at sy
Superhård materialesyntese gjort billigereGrafisk abstrakt. Kredit:Uorganisk kemi (2022). DOI:10.1021/acs.inorgchem.1c03880 Skoltech-forskere og deres kolleger fra Tomsk Polytechnic University har foreslået en effektiv og billig måde at sy
- Hvad er ændringen af momentum en kugle kastet mod væggen?
- Facebook -chef er vært for konservative gæster midt i partiskabelse
- Tid, sted og hvordan træ bruges er faktorer i kulstofemissioner fra skovrydning
- Hvad er det rigtige navn på sammensat fes?
- Hvad kredserer planeterne i vores solsystem?
- Force field analyse giver spor til protein-ion interaktion


