Hvordan relaterer lagret kemisk energi til bindinger?
1. Bonds Store Energy:
* Kemiske bindinger dannes, når atomer deler eller overfører elektroner. Denne proces frigiver energi og skaber en stabil, lavere energistilstand.
* Den energi, der frigives under dannelse af obligationer, opbevares i selve bindingen. Denne lagrede energi kaldes Bond Energy .
2. Breaking Bonds kræver energi:
* For at bryde en obligation skal der tilføjes energi. Dette skyldes, at knækningen af bindingen forstyrrer molekylets stabile, lavere energistilstand.
* Mængden af energi, der kræves for at bryde en binding, er lig med bindingsenergien.
3. Kemiske reaktioner:
* Kemiske reaktioner involverer brud og dannelse af kemiske bindinger.
* Hvis den energi, der frigives ved at danne nye obligationer, er større end den energi, der kræves for at bryde eksisterende bindinger, frigiver reaktionen energi og er eksoterm .
* Hvis den energi, der kræves for at bryde bindinger, er større end den energi, der frigives ved at danne nye bindinger, kræver reaktionen energi for at fortsætte og er endotermisk .
Eksempler:
* brændende træ: Bindingerne i træmolekyler opbevarer kemisk energi. Når du brænder træ, er bindingerne brudt og frigiver energi i form af varme og lys.
* Fotosyntese: Planter bruger sollys energi til at bryde bindingerne i vand og kuldioxidmolekyler, danner glukose (sukker) og ilt. Denne proces opbevarer energi i glukosens bindinger.
* Cellulær respiration: Vores kroppe nedbryder glukosemolekyler og frigiver den lagrede kemiske energi til at drive vores celler. Denne energiudgivelse forekommer ved at bryde og danne obligationer.
Nøglekoncepter:
* Højere obligationsenergi: Stærkere obligationer opbevarer mere energi.
* Typer af obligationer: Forskellige typer bindinger (kovalente, ioniske osv.) Har forskellige bindingsenergier.
* lagret vs. frigivet energi: Kemisk energi kan opbevares inden for bindinger eller frigøres under reaktioner.
I det væsentlige er lagret kemisk energi en konsekvens af den energi, der frigives under bindingsdannelse og repræsenterer potentialet for energifrigivelse, når disse bindinger er brudt. Det er et vigtigt koncept for at forstå, hvordan energi overføres og bruges i kemiske processer.
 Varme artikler
Varme artikler
-
 Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning
Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning -
 Massespektrometrisk billeddannelsesteknik gør diagnosticering nemmere og smartereHøj opløsning atmosfærisk tryk massespektrometri billeddannelsessystem. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold ved DGIST har for nylig udviklet en teknol
Massespektrometrisk billeddannelsesteknik gør diagnosticering nemmere og smartereHøj opløsning atmosfærisk tryk massespektrometri billeddannelsessystem. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold ved DGIST har for nylig udviklet en teknol -
 Forskere udvikler teknik til at genbruge kuldioxid og metanCLS-forskerne Yongfeng Hu og Hui Wang. Kredit:University of Saskatchewan CO2 og metan er de mest betydelige drivhusgasser som følge af menneskelig aktivitet, sagde Hui Wang, professor ved Institut
Forskere udvikler teknik til at genbruge kuldioxid og metanCLS-forskerne Yongfeng Hu og Hui Wang. Kredit:University of Saskatchewan CO2 og metan er de mest betydelige drivhusgasser som følge af menneskelig aktivitet, sagde Hui Wang, professor ved Institut -
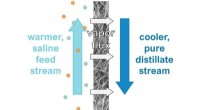 Hvordan gør man et bedre stykke arbejde med at rense saltvand? Ved at holde afsaltningsværktøj tø…Den varme vandstrøm med høj saltholdighed er på den ene side af membranen og en kølig ren vandstrøm på den anden. det opvarmede vand fordamper, efterlader saltet og danner en damp, som omdannes til en
Hvordan gør man et bedre stykke arbejde med at rense saltvand? Ved at holde afsaltningsværktøj tø…Den varme vandstrøm med høj saltholdighed er på den ene side af membranen og en kølig ren vandstrøm på den anden. det opvarmede vand fordamper, efterlader saltet og danner en damp, som omdannes til en
- Sociale flagermus betaler en pris:Svampesygdom, hvid-næse-syndrom ... udryddelse?
- Hvorfor blev varmeovne opfundet?
- Afklaring af mekanismen til undertrykkelse af turbulens gennem ionmasse
- Hvordan adskiller kræftcellers opførsel sig fra de normale celler?
- Hvad sker der, når Earths Energy -budgettet ændres?
- Er en cykelkyst på niveau på niveau fortovspotentiale eller kinetisk energi?


