Hvorfor er 4 methylpyridin mere basisk?
Forståelse af grundlæggende
* Elektrondonation: Grundlighed i organiske forbindelser vedrører ofte, hvor let et molekyle kan donere et elektronpar. Jo lettere en forbindelse kan donere sit ensomme par elektroner, jo mere grundlæggende er det.
* Pyridins nitrogen: Pyridin har et nitrogenatom med et ensomt par elektroner. Dette ensomme par er tilgængeligt til binding med en proton (H+) til dannelse af en pyridiniumion, hvilket gør pyridin til en base.
Hvorfor 4-methylpyridin er mere grundlæggende
* induktiv effekt: Methylgruppen (CH3) fastgjort til pyridinringen i 4-methylpyridin er en elektron-donerende gruppe. Dette betyder, at det skubber elektrondensitet mod ringen, inklusive nitrogenatomet.
* elektrondensitet ved nitrogen: Øget elektrondensitet på nitrogenatomet gør sit ensomme par mere tilgængeligt til donation. Dette gør 4-methylpyridin til en stærkere base end pyridin selv.
Kortfattet:
Methylgruppen i 4-methylpyridin øger elektrondensiteten på nitrogenatomet, hvilket gør det lettere donerer sit ensomme par og dermed mere basale.
 Varme artikler
Varme artikler
-
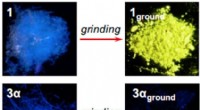 Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ
Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ -
 Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit
Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit -
 Boblefangst overflade hjælper med at slippe af med skumI to identiske bægerglas med en konstant strøm af bobler, ved at indsætte et stykke af det nye teksturerede materiale, der er udviklet af MIT -teamet (til højre), får skumdannelsen i toppen af bæger
Boblefangst overflade hjælper med at slippe af med skumI to identiske bægerglas med en konstant strøm af bobler, ved at indsætte et stykke af det nye teksturerede materiale, der er udviklet af MIT -teamet (til højre), får skumdannelsen i toppen af bæger -
 Tågeharpe øger opsamlingskapaciteten for rent vandUndersøgelsesforfatter Josh Tulkoff konstruerer en stor prototype af tågeharpen, som består af et lodret array på 700 ledninger og er baseret på første eksperimentelle resultater. Tulkoff var en del a
Tågeharpe øger opsamlingskapaciteten for rent vandUndersøgelsesforfatter Josh Tulkoff konstruerer en stor prototype af tågeharpen, som består af et lodret array på 700 ledninger og er baseret på første eksperimentelle resultater. Tulkoff var en del a
- Hvad er den elektromagnetiske spektrumskoefficient for universet?
- Hvad er den mest sandsynlige effekt, som et fald i plantelivet i biosfæren ville have på atmosfær…
- Rev dør. Forskere håber, laboratorieopdrættede superkoraller kan hjælpe med at genoplive dem
- Hvad hedder den største vulkan på jorden?
- Sådan konverteres MG til MMOL /L
- Ultrasensitiv giftig detektor


