Har en ion de samme egenskaber som dens tilsvarende ædle gas?
* Elektronkonfiguration: Ioner opnår stabilitet ved at vinde eller miste elektroner for at opnå den samme elektronkonfiguration som deres nærmeste ædle gas. Selvom det betyder, at de har det samme antal elektroner i deres yderste skal som den ædle gas, er den samlede elektronkonfiguration forskellig.
* opladning: Ioner bærer en netto elektrisk ladning, enten positive (kationer) eller negative (anioner). Noble gasser er på den anden side neutrale atomer.
* Kemisk reaktivitet: Ædle gasser er kendt for deres inertitet og manglende reaktivitet. Ioner er imidlertid kemisk aktive på grund af deres anklager og deres ønske om at genvinde en neutral tilstand.
* Fysiske egenskaber: Fysiske egenskaber som smeltepunkt, kogepunkt og densitet kan variere markant mellem en ion og dens tilsvarende ædelgas.
Eksempel:
Natrium (NA) har en valenselektron, mens neon (NE) har en fuld ydre skal af elektroner. Når natrium mister et elektron for at blive en natriumion (Na+), har det den samme elektronkonfiguration som neon. Na+ er imidlertid en positivt ladet ion med forskellige kemiske og fysiske egenskaber end neon, som er en neutral, ureaktiv gas.
Kortfattet: Mens en ion kan dele den samme elektronkonfiguration i sin yderste skal som dens tilsvarende ædle gas, adskiller den sig markant ansvarlig, reaktivitet og andre egenskaber.
 Varme artikler
Varme artikler
-
 Afdækning af hemmelighederne bag materialenedbrydning i et lithium-ion-batteriSkematisk diagram af KIST batterianalyseplatform. Kredit:Korea Institute of Science and Technology (KIST) Midt i den globale indsats for CO2-neutralitet er bilproducenter over hele verden aktivt en
Afdækning af hemmelighederne bag materialenedbrydning i et lithium-ion-batteriSkematisk diagram af KIST batterianalyseplatform. Kredit:Korea Institute of Science and Technology (KIST) Midt i den globale indsats for CO2-neutralitet er bilproducenter over hele verden aktivt en -
 Løsning af plastikmanglen med en ny kemisk katalysatorKredit:CC0 Public Domain I et år, der allerede har ramt produktionsforsyningskæder, endnu en mangel komplicerer producenters og forbrugeres liv:plastik, og fødevareemballagen, bilkomponenter, tøj,
Løsning af plastikmanglen med en ny kemisk katalysatorKredit:CC0 Public Domain I et år, der allerede har ramt produktionsforsyningskæder, endnu en mangel komplicerer producenters og forbrugeres liv:plastik, og fødevareemballagen, bilkomponenter, tøj, -
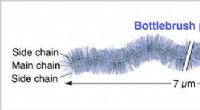 Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy
Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy -
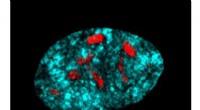 Beskyttelse af ribosomgener for at forhindre aldringI mangel af SIRT7, en menneskelig primærcelle viser flere nucleoli. DNA blev farvet med DAPI (turkis), og nucleolus blev farvet med anti-fibrillarin (rød). Kredit:Silvana Paredes Aldring er en pro
Beskyttelse af ribosomgener for at forhindre aldringI mangel af SIRT7, en menneskelig primærcelle viser flere nucleoli. DNA blev farvet med DAPI (turkis), og nucleolus blev farvet med anti-fibrillarin (rød). Kredit:Silvana Paredes Aldring er en pro
- Hvilke egenskaber ændres ikke, når sukker opløses i vand?
- Hvilke strukturer holder kromosomerne sammen?
- Ny matematisk model forklarer, hvordan værter overlever parasitangreb
- Hvor mange stik med 15 amp 14 gauge wire?
- Yngre lag af uforstyrret sedimentær klippe er over ældre ifølge?
- Bløde kugler sætter sig i noget overraskende struktur


