Hvordan påvirker tempen opløselighed af de fleste faste stoffer?
Her er hvorfor:
* kinetisk energi: Når temperaturen stiger, får molekylerne i både det faste og væske mere kinetisk energi. Dette betyder, at de bevæger sig hurtigere og kolliderer oftere.
* Breaking Bonds: Den øgede kinetiske energi hjælper med at overvinde kræfterne, der holder fastens molekyler sammen (gitterstrukturen), hvilket gør det lettere for dem at gå i stykker og opløses i væsken.
* øget interaktion: De hurtigere bevægende molekyler af både det faste stof og væsken interagerer hyppigere og med større kraft, hvilket fører til en større opløsningshastighed.
Undtagelser:
Selvom dette generelt er sandt, er der nogle undtagelser:
* Gasser: Opløseligheden af gasser i væsker * falder * med stigende temperatur. Dette skyldes, at højere temperaturer får gasmolekyler til at flygte lettere fra væsken.
* Visse salte: Et par salte, som lithiumsulfat (li₂so₄), bliver faktisk * mindre * opløselig, når temperaturen stiger.
Vigtig note:
Den specifikke virkning af temperatur på opløselighed kan variere afhængigt af den specifikke faste og væske, der er involveret. Generelt gør det at hæve temperaturen det lettere for de fleste faste stoffer at opløses.
Sidste artikelNår et bundfald dannes, er den kemiske ændring?
Næste artikelHvad er en antacid lavet af?
 Varme artikler
Varme artikler
-
 Forskere bruger hele levende celler som skabeloner til at søge efter bioaktive molekylerHuman lungeadeconarcinomcelle brugt i denne forskning. Kredit:Daniel Carbajo En undersøgelse udført af forskere ved Institute for Advanced Chemistry of Catalonia (IQAC) fra det spanske nationale f
Forskere bruger hele levende celler som skabeloner til at søge efter bioaktive molekylerHuman lungeadeconarcinomcelle brugt i denne forskning. Kredit:Daniel Carbajo En undersøgelse udført af forskere ved Institute for Advanced Chemistry of Catalonia (IQAC) fra det spanske nationale f -
 Maskinindlæringssoftware forudsiger bakteriers adfærdEn kunstners skildring af en bakteriecelle. Kredit:Centers for Disease Control and Prevention/James Archer I den første til maskinlæringsalgoritmer, et nyt stykke software udviklet hos Caltech kan
Maskinindlæringssoftware forudsiger bakteriers adfærdEn kunstners skildring af en bakteriecelle. Kredit:Centers for Disease Control and Prevention/James Archer I den første til maskinlæringsalgoritmer, et nyt stykke software udviklet hos Caltech kan -
 Forskere skubber mikroskopi til sub-molekylær opløsningAt være i stand til at se den indre funktion af de grundlæggende enheder i alt stof er virkelig fantastisk, og det er et af hovedmålene, vi har forfulgt hos CaSTL i mere end et årti, ” siger studie me
Forskere skubber mikroskopi til sub-molekylær opløsningAt være i stand til at se den indre funktion af de grundlæggende enheder i alt stof er virkelig fantastisk, og det er et af hovedmålene, vi har forfulgt hos CaSTL i mere end et årti, ” siger studie me -
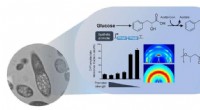 Et-trins produktion af aromatiske polyestere af E. coli-stammerBiosyntese af aromatiske polyestere ved metabolisk manipuleret E coli .Dette skematiske diagram viser den overordnede konceptualisering af, hvordan metabolisk manipuleret E coli fremstillet aromat
Et-trins produktion af aromatiske polyestere af E. coli-stammerBiosyntese af aromatiske polyestere ved metabolisk manipuleret E coli .Dette skematiske diagram viser den overordnede konceptualisering af, hvordan metabolisk manipuleret E coli fremstillet aromat
- Video:Vil det kombucha?
- WD-40 Hvad kan du bruge det på?
- Hvad sker der med hastigheden på en lysbølge, når den bevæger sig fra luftvæske?
- Hvis en foton reflekteres fra spejlet, skal du ændre sig i momentum af IS?
- Mikro-robotter kunne gå inde i kroppen og spore vitale tegn, siger professor
- Gimmick eller effektiv? Virkningerne af fantasifulde visninger på kundernes købsadfærd


