Hvordan skriver du den afbalancerede ligning mellem en syre og en base?
forståelse af reaktionen
* syre-base-reaktioner: Når en syre reagerer med en base, neutraliserer de hinanden og danner salt og vand. Dette kaldes en neutraliseringsreaktion.
* Generel formel: Syre + base → salt + vand
trin til at afbalancere ligningen
1. Identificer reaktanterne:
* syre: Vil have en kemisk formel, der starter med "H" (f.eks. HCL, H₂so₄).
* base: Vil typisk have en hydroxidion (OH⁻) i sin formel (f.eks. NaOH, Ca (OH) ₂).
2. Skriv den ubalancerede ligning:
* Placer de kemiske formler af syren og basen på venstre side af ligningen, adskilt med et plustegn.
* Placer de kemiske formler for salt og vand på højre side af ligningen, adskilt med et plustegn.
3. Balance elementerne:
* brint (H): Tæl antallet af brintatomer på hver side. Juster koefficienterne (tal foran formlerne) efter behov for at gøre antallet af brintatomer lige på begge sider.
* ilt (O): Tæl antallet af iltatomer på hver side. Juster om nødvendigt koefficienter.
* Andre elementer: Fortsæt med at afbalancere de andre elementer i ligningen ved at justere koefficienter.
4. dobbeltkontrol: Sørg for, at antallet af atomer i hvert element er det samme på begge sider af ligningen.
Eksempel:Hydrochlorsyre (HCI) reagerer med natriumhydroxid (NaOH)
1. reaktanter:
* HCL (syre)
* Naoh (base)
2. ubalanceret ligning:
* HCL + NaOH → NaCl + H₂O
3. afbalancering:
* h: 1 til venstre, 3 til højre. Juster HCL -koefficienten til 2:
* 2HCl + NaOH → NaCl + H₂O
* o: Nu 2 til venstre, 1 til højre. Juster H₂O -koefficienten til 2:
* 2HCl + NaOH → NaCl + 2H₂O
* NA: Nu 1 på hver side.
* Cl: Nu 2 på hver side.
4. afbalanceret ligning:
* 2HCl + NaOH → NaCl + 2H₂O
Nøglepunkter
* Afbalancering af kemiske ligninger er afgørende for at repræsentere nøjagtige kemiske reaktioner.
* Koefficienter skal være hele tal.
* Øv afbalanceringsligninger med forskellige syrer og baser for at blive komfortable med processen.
 Varme artikler
Varme artikler
-
 Kunstig intelligens identificerer den optimale materialeformelEt kig ind i sprutsystemet, hvor nanostrukturerede lag genereres. Kredit:Lars Banko Nanostrukturerede lag kan prale af utallige potentielle egenskaber - men hvordan kan den bedst egnede identifice
Kunstig intelligens identificerer den optimale materialeformelEt kig ind i sprutsystemet, hvor nanostrukturerede lag genereres. Kredit:Lars Banko Nanostrukturerede lag kan prale af utallige potentielle egenskaber - men hvordan kan den bedst egnede identifice -
 Materialer, der åbner i øjeblikkets varmeSommerfuglformede ligander var nøglen til at designe et materiale, der selektivt kan absorbere og lagre forskellige gasmolekyler. Kredit:Izumi Mindy Takamiya Kyoto-universitetets forskere har desi
Materialer, der åbner i øjeblikkets varmeSommerfuglformede ligander var nøglen til at designe et materiale, der selektivt kan absorbere og lagre forskellige gasmolekyler. Kredit:Izumi Mindy Takamiya Kyoto-universitetets forskere har desi -
 Samarbejde sætter gang i en ny model for keramisk ledningsevneKredit:CC0 Public Domain Som isolatorer, metaloxider - også kendt som keramik - virker måske ikke som oplagte kandidater til elektrisk ledningsevne. Mens elektroner lyner frem og tilbage i alminde
Samarbejde sætter gang i en ny model for keramisk ledningsevneKredit:CC0 Public Domain Som isolatorer, metaloxider - også kendt som keramik - virker måske ikke som oplagte kandidater til elektrisk ledningsevne. Mens elektroner lyner frem og tilbage i alminde -
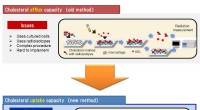 En ny praktisk test for funktionen af HDL, bæreren af det gode kolesterolKolesteroludstrømningskapacitet og optagelseskapacitet er vist. Kredit:Kobe University High-density lipoprotein kolesterol (HDL-C) er kendt som godt kolesterol, fordi HDL-partikler fjerner oversky
En ny praktisk test for funktionen af HDL, bæreren af det gode kolesterolKolesteroludstrømningskapacitet og optagelseskapacitet er vist. Kredit:Kobe University High-density lipoprotein kolesterol (HDL-C) er kendt som godt kolesterol, fordi HDL-partikler fjerner oversky
- Dobbelt-duty-katalysator genererer brintbrændstof, mens den renser spildevand
- Nyt værktøj til tidlig påvisning af blågrønalger
- Ny katalysator gør ammoniak til et innovativt rent brændstof
- Fakta om elektrisk energi til børn
- Hvad studerer du i bioteknologi?
- Hvilken geokemisk cyklus involverer mantelkonvektion?


