Hvad er den kemiske reaktion, som Shwos af zink med salpetersyre til at producere en (II) nitratopløsning og brint?
reaktionen:
Zink (Zn) reagerer med salpetersyre (HNO₃) for at producere zink (II) nitrat (Zn (NO₃) ₂) og forskellige nitrogenoxider (NOₓ) afhængigt af syrens koncentration.
Den afbalancerede kemiske ligning:
Reaktionen kan forenkles ved hjælp af følgende afbalancerede kemiske ligning:
Zn (S) + 4 HNO₃ (aq) → Zn (NO₃) ₂ (aq) + 2 no₂ (g) + 2 H₂O (l)
Forklaring:
* zink (Zn) oxideres til dannelse af zink (II) -ioner (Zn²⁺).
* salpetersyre (HNO₃) fungerer som både en oxidationsmiddel og en syre.
* nitrogendioxid (ingen₂) gas produceres som et resultat af, at salpetersyren reduceres.
* vand (H₂O) produceres også som et biprodukt.
Hvorfor ikke brint?
Salpetersyre er et stærkt oxidationsmiddel. Dette betyder, at det let accepterer elektroner og forhindrer dannelse af brintgas. I stedet reduceres salpetersyren i sig selv, hvilket fører til produktion af nitrogenoxider.
Bemærk: Det specifikke nitrogenoxidprodukt (nej, ingen₂, N₂O) afhænger af koncentrationen af salpetersyre og reaktionsbetingelserne.
 Varme artikler
Varme artikler
-
 Langtidsstudie af limede stålarmeringer på en betonbjælke går ind i 50. årEmpa-ingeniørerne Christoph Czaderski (th.) og Robert Widmann måler betonbjælken 50 år efter forsøgets start. Kredit:Empa I et halvt århundrede nu, et langsigtet eksperiment har kørt i Empas størs
Langtidsstudie af limede stålarmeringer på en betonbjælke går ind i 50. årEmpa-ingeniørerne Christoph Czaderski (th.) og Robert Widmann måler betonbjælken 50 år efter forsøgets start. Kredit:Empa I et halvt århundrede nu, et langsigtet eksperiment har kørt i Empas størs -
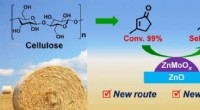 Forskere syntetiserer bio-baseret methylcyclopentadien med 3-methylcyclopent-2-enonDirekte hydrodeoxygenering af MCP til MCPD på den delvist reducerede Zn-Mo-oxidkatalysator. Kredit:DICP Methylcyclopentadien (MCPD) er en vigtig monomer i produktionen af RJ-4 brændstof, et rake
Forskere syntetiserer bio-baseret methylcyclopentadien med 3-methylcyclopent-2-enonDirekte hydrodeoxygenering af MCP til MCPD på den delvist reducerede Zn-Mo-oxidkatalysator. Kredit:DICP Methylcyclopentadien (MCPD) er en vigtig monomer i produktionen af RJ-4 brændstof, et rake -
 Et hurtigt malariatest -kit, der kan hjælpe diagnosen i udviklingslandeEt nærbillede af en prototype af det NTU-udviklede hurtige malariatestsæt. Kredit:NTU Singapore Et team af forskere fra Nanyang Technological University, Singapore (NTU Singapore) har udviklet et
Et hurtigt malariatest -kit, der kan hjælpe diagnosen i udviklingslandeEt nærbillede af en prototype af det NTU-udviklede hurtige malariatestsæt. Kredit:NTU Singapore Et team af forskere fra Nanyang Technological University, Singapore (NTU Singapore) har udviklet et -
 Brændselscelle røntgenundersøgelse beskriver virkningerne af temperatur og fugt på ydeevnenEn røntgenundersøgelse afslørede størrelsen og fordelingen af bittesmå lommer af vand i fibrøse brændstofcellekomponenter ved forskellige temperaturer. Kredit:Berkeley Lab Som en velplejet drivh
Brændselscelle røntgenundersøgelse beskriver virkningerne af temperatur og fugt på ydeevnenEn røntgenundersøgelse afslørede størrelsen og fordelingen af bittesmå lommer af vand i fibrøse brændstofcellekomponenter ved forskellige temperaturer. Kredit:Berkeley Lab Som en velplejet drivh
- NASAs Aqua Satellite finder den tropiske cyklon Fani stærkere, mere organiseret
- Hvordan forklarer baseparringsregler, hvordan en DNA-streng fungerer som skabelon under replikation?…
- Når støvet forsvinder, hvad er det næste for Sony?
- Havets frugtbarhed:Forskere studerer, hvordan næringskilder får det til at danne fødenettet
- Hvad er forskellen mellem ren ANS -blandet stof?
- Når luft afkøles, holder den så meget vanddamp, så gør hvad til en væske eller danner iskrysta…


