Hvilket element på den periodiske tabel har kemiske egenskaber, der ligner mest de kulstof?
Her er hvorfor:
* samme gruppe: Både carbon og silicium hører til gruppe 14 (IVA) i den periodiske tabel. Elementer i den samme gruppe har lignende kemiske egenskaber på grund af at have det samme antal valenselektroner (elektroner i den yderste skal).
* Valenselektroner: Både carbon og silicium har fire valenselektroner, hvilket giver dem mulighed for at danne fire kovalente bindinger.
* Evne til at danne kæder og ringe: Begge elementer kan danne lange kæder og komplekse ringstrukturer. Denne egenskab er vigtig for dannelsen af store og forskellige molekyler, ligesom dem, der findes i organisk kemi.
Der er dog nogle forskelle:
* Elektronegativitet: Carbon er mere elektronegativ end silicium, hvilket betyder, at det tiltrækker elektroner stærkere.
* obligationsstyrke: Silicium-siliciumbindinger er svagere end carbon-carbonbindinger, hvilket gør siliciumforbindelser mindre stabile under visse betingelser.
* reaktivitet: Silicium er generelt mere reaktivt end kulstof, især med ilt.
Kortfattet: Mens der er forskelle, gør lighederne i deres valenselektronkonfiguration og bindingsfunktioner silicium til det nærmeste element til kulstof med hensyn til kemisk opførsel.
Sidste artikelMolekylær ligning til forbrænding af metangas?
Næste artikelHvad er opløsningen og opløsningsmidlet af en alkohol?
 Varme artikler
Varme artikler
-
 Et laserfokus på at finde bedre måder at lave vedvarende brændstoffer påJay Winkler og hans team zapper metaller for at skabe nye solenergi-brændstofkatalysatorer. Kredit:California Institute of Technology I jagten på alternativer til oliebaserede brændstoffer, en af
Et laserfokus på at finde bedre måder at lave vedvarende brændstoffer påJay Winkler og hans team zapper metaller for at skabe nye solenergi-brændstofkatalysatorer. Kredit:California Institute of Technology I jagten på alternativer til oliebaserede brændstoffer, en af -
 Hvordan dannes dis? Sod som en overraskende kilde til dis-opbyggende hydroxylradikalerKredit:© Wiley-VCH Uklarhed dannes, når en cocktail af forskellige gasformige forurenende stoffer oxideres og danner partikler, der spreder sollys. Denne proces er hovedsageligt medieret af hydroxy
Hvordan dannes dis? Sod som en overraskende kilde til dis-opbyggende hydroxylradikalerKredit:© Wiley-VCH Uklarhed dannes, når en cocktail af forskellige gasformige forurenende stoffer oxideres og danner partikler, der spreder sollys. Denne proces er hovedsageligt medieret af hydroxy -
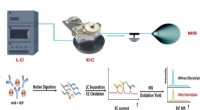 Forskere låser op for en ny metode til at teste proteinbaserede lægemidlerWorkflow af NJIT-teamets CMS-metode, der kombinerer væskekromatografi (LC), elektrokemisk oxidation (EC) og massespektrometri (MS)-baseret kvantitativ måling af proteinoverflod. Kredit:NJIT New Jer
Forskere låser op for en ny metode til at teste proteinbaserede lægemidlerWorkflow af NJIT-teamets CMS-metode, der kombinerer væskekromatografi (LC), elektrokemisk oxidation (EC) og massespektrometri (MS)-baseret kvantitativ måling af proteinoverflod. Kredit:NJIT New Jer -
 Forskere foreslår en miljøvenlig måde at opnå højaktive katalysatorer påProcessen med katalysatordannelse ved hjælp af polymerkroppe, palladium- og rhodiumsalte af organisk syre. Kredit:Anna Shpichka Et hold fra Sechenov Universitet og russiske kolleger udviklede en m
Forskere foreslår en miljøvenlig måde at opnå højaktive katalysatorer påProcessen med katalysatordannelse ved hjælp af polymerkroppe, palladium- og rhodiumsalte af organisk syre. Kredit:Anna Shpichka Et hold fra Sechenov Universitet og russiske kolleger udviklede en m


