Hvad er natrium og calcium i formioniske forbindelser?
Forståelse af ioniske forbindelser
* ioniske bindinger: Ioniske forbindelser dannes, når et metalatom (som natrium eller calcium) donerer en eller flere elektroner til et ikke -metal atom. Denne overførsel af elektroner skaber positivt ladede ioner (kationer) og negativt ladede ioner (anioner). De modsatte afgifter tiltrækker og danner en stærk elektrostatisk binding.
natrium (NA)
* natriumion (Na+): Natrium er i gruppe 1 i den periodiske tabel, hvilket betyder, at den har en valenselektron (elektron i dets yderste skal). Det mister let denne elektron for at opnå en stabil elektronkonfiguration. Når det mister elektronet, bliver det en positivt ladet ion (Na+).
calcium (CA)
* calciumion (Ca2+): Calcium er i gruppe 2 i den periodiske tabel med to valenselektroner. Det mister begge disse elektroner for at blive en stabil ion, der danner en +2 ladning (Ca2 +).
danner ioniske forbindelser
Ioniske forbindelser indeholder altid både en kation (positiv ion) og en anion (negativ ion). For at forudsige formlen for en ionisk forbindelse skal du overveje anklagerne for de involverede ioner:
* natriumchlorid (NaCl): Natrium (Na+) kombineres med klor (CL-), som får et elektron til dannelse af en -1 -ladning. Gebyrerne afbalanceres, hvilket resulterer i et forhold på 1:1 mellem ioner i forbindelsen.
* Calciumchlorid (CACL2): Calcium (Ca2+) kombineres med klor (Cl-). For at afbalancere +2 ladning af calcium er der behov for to chloridioner (-1 hver).
* natriumoxid (NA2O): Natrium (Na+) kombineres med ilt (O2-), som får to elektroner til at danne en -2 -ladning. To natriumioner er nødvendige for at afbalancere -2 -ladningen af oxidionen.
Nøglepunkter
* forudsigelse af formler: Antallet af hver ion i formlen bestemmes af ladningerne af ionerne for at sikre en neutral samlet ladning.
* Empiriske formler: Ioniske forbindelsesformler er normalt empiriske formler, hvilket betyder, at de repræsenterer det enkleste forhold mellem helnummeret for ioner i forbindelsen.
* Krystallinske strukturer: Ioniske forbindelser danner krystalgitter, hvor ionerne er arrangeret i et gentagende mønster.
Sidste artikelHvad er lave koncentrerede løsninger?
Næste artikelHvad er saltvandingredienser?
 Varme artikler
Varme artikler
-
 Nyt system sikrer sporbarhed i tekstilindustrienFoto af sporbarhedsmærke. Kredit:Solveig Klug Hvordan kan en beklædningsgenstands oprindelse udledes på en sikker og troværdig måde? Hvordan kan producenten garantere, at den er produceret i et so
Nyt system sikrer sporbarhed i tekstilindustrienFoto af sporbarhedsmærke. Kredit:Solveig Klug Hvordan kan en beklædningsgenstands oprindelse udledes på en sikker og troværdig måde? Hvordan kan producenten garantere, at den er produceret i et so -
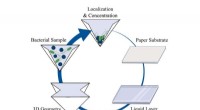 Foldet papir skaber et bærbart laboratorium til feltlaboratorietestsOvervågning og sporing af biologiske trusler eller epidemier kræver evnen til at udføre test i marken under barske situationer. Dyrt laboratorieudstyr er ofte ikke tilgængeligt i disse indstillinger,
Foldet papir skaber et bærbart laboratorium til feltlaboratorietestsOvervågning og sporing af biologiske trusler eller epidemier kræver evnen til at udføre test i marken under barske situationer. Dyrt laboratorieudstyr er ofte ikke tilgængeligt i disse indstillinger, -
 Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning
Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning -
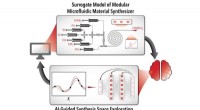 Virtuelt laboratorium finder det rigtige AI-værktøj til hvert kemiproblemKredit:North Carolina State University At have det rigtige værktøj til jobbet gør arbejdet meget lettere, billigere og hurtigere. Kemiingeniørforskere har nu udviklet et virtuelt laboratorium, der
Virtuelt laboratorium finder det rigtige AI-værktøj til hvert kemiproblemKredit:North Carolina State University At have det rigtige værktøj til jobbet gør arbejdet meget lettere, billigere og hurtigere. Kemiingeniørforskere har nu udviklet et virtuelt laboratorium, der
- Kan planeterne i et solsystem betragtes som satellitter af deres sol?
- Teori hjælper med analyse af nukleare materialer
- Supermassive sorte huller kort efter Big Bang:Sådan sås dem
- Ved 15,6 millioner grader Celsius er temperaturen i Solens kerne høj nok til at nukleart hvad der k…
- Den primære årsag til at sprede mange radioteleskoper over et stort område og kombinere signalern…
- MR, på en molekylær skala:Team udvikler system, der kan se ind i atomstrukturen af individuelle …


