Du kan finde pH -værdien ved at bruge?
1. pH meter: Dette er den mest nøjagtige og almindelige metode. En pH -meter bruger en elektrode, der er følsom over for hydrogenioner (H+) i opløsningen. Det måler den elektriske potentialeforskel mellem elektroden og en referencelektrode, og denne forskel er direkte relateret til pH.
2. pH -indikator: Denne metode bruger kemiske stoffer, der ændrer farve afhængigt af pH i opløsningen. Disse indikatorer fås i flydende eller papirform (lakmuspapir). Farveændringen af indikatoren sammenlignes med et farvekort for at bestemme den omtrentlige pH.
3. PH -teststrimler: Disse ligner PH -indikatorer, men er designet til at være mere praktiske til hurtig test. De er strimler af papir, der er imprægneret med flere pH -indikatorer, og det resulterende farvemønster sammenlignes med et diagram for at bestemme pH.
4. Universal indikator: Dette er en blanding af flere pH -indikatorer, der producerer en gradvis farveændring over et bredt pH -område. Det bruges ofte til at få et groft skøn over pH.
5. Beregning: Hvis du kender koncentrationen af hydrogenioner (H+) i opløsningen, kan du beregne pH ved hjælp af følgende formel:
ph =-log [H+]
Hvor:
* [H+] er koncentrationen af brintioner i mol pr. Liter (mol/L).
Bemærk: Mens alle disse metoder kan hjælpe dig med at finde pH for et stof, varierer nøjagtigheden og præcisionen af hver metode. PH -målere er generelt de mest nøjagtige, mens pH -indikatorer og teststrimler giver et groft estimat.
 Varme artikler
Varme artikler
-
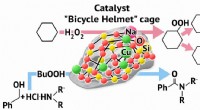 Chemist udvikler en ny katalysator til oxidation og amideringEn RUDN-kemiker udviklede en ny katalysator for oxidation og amidering Kredit:Allen Dressen En RUDN-kemiker har fået en forbindelse med en ny strukturel type, der indeholder atomer af metaller (ko
Chemist udvikler en ny katalysator til oxidation og amideringEn RUDN-kemiker udviklede en ny katalysator for oxidation og amidering Kredit:Allen Dressen En RUDN-kemiker har fået en forbindelse med en ny strukturel type, der indeholder atomer af metaller (ko -
 Et nyt potentielt alternativ til myggebekæmpelse opdagetKredit:CC0 Public Domain Naturlige æteriske olier udvundet af skallen af en citrusfrugt kunne være et effektivt nyt miljøvenligt alternativ i myggekontrolprogrammer, rapporterer en ny undersøgel
Et nyt potentielt alternativ til myggebekæmpelse opdagetKredit:CC0 Public Domain Naturlige æteriske olier udvundet af skallen af en citrusfrugt kunne være et effektivt nyt miljøvenligt alternativ i myggekontrolprogrammer, rapporterer en ny undersøgel -
 Fra fladskærms -tv til din smartphone - elementet bor fortjener mere opmærksomhedBor ignoreres ofte, men det har mange vigtige kvaliteter. Kredit:David Ellis/Flickr, CC BY-NC-ND Hver gang du ser sport på et fladskærms -tv, eller send en besked ved at røre ved din smartphones s
Fra fladskærms -tv til din smartphone - elementet bor fortjener mere opmærksomhedBor ignoreres ofte, men det har mange vigtige kvaliteter. Kredit:David Ellis/Flickr, CC BY-NC-ND Hver gang du ser sport på et fladskærms -tv, eller send en besked ved at røre ved din smartphones s -
 MagLab-forskere opdager termoelektriske egenskaber i lovende materialeklasseMagLab-fysikerne Ryan Baumbach (til venstre) og Kaya Wei studerer en klasse af materialer med lovende termoelektriske egenskaber. Kredit:Stephen Bilenky/National MagLab At udforske et område, der
MagLab-forskere opdager termoelektriske egenskaber i lovende materialeklasseMagLab-fysikerne Ryan Baumbach (til venstre) og Kaya Wei studerer en klasse af materialer med lovende termoelektriske egenskaber. Kredit:Stephen Bilenky/National MagLab At udforske et område, der
- Støvet stjernedannende galakse MAMBO-9 undersøgt i detaljer
- Milky Ways center vil blive afsløret af NASAs Webb Telescope
- En saltbro er nødvendig i en elektrokemisk celle for at buffer give ioner opfører sig som elektrod…
- Kan en fire-årig være sexistisk?
- Apples aktier surner, Microsofts svæver. Sig hvad?!
- Ny type triterpener opdaget


