Hvordan beregner du hydrogenionkoncentration af pH 6,2?
forståelse af forholdet
* ph er et mål for surhedsgraden eller alkaliniteten af en opløsning. Det er defineret som den negative logaritme (base 10) af hydrogenionkoncentrationen:
ph =-log [H+]
* [H+] er hydrogenionkoncentrationen, udtrykt i mol pr. Liter (mol/L).
Beregning
1. Omarranger pH -ligningen for at løse for [H+]:
[H+] =10^(-Ph)
2. erstatte den givne pH -værdi:
[H+] =10^(-6.2)
3. Beregn ved hjælp af en lommeregner:
[H+] ≈ 6,31 x 10^-7 mol/l
Derfor er hydrogenionkoncentrationen af en opløsning med en pH på 6,2 ca. 6,31 x 10^-7 mol/l.
 Varme artikler
Varme artikler
-
 Hvad er der i denne plante? Det bedste automatiserede system til at finde potentielle stofferDen nye metode til beregningsmæssig massespektrometri vil fremskynde opdagelsen af naturlige produkter, der kunne bruges i medicin. Kredit:Public domain Forskere ved RIKEN Center for Sustainable
Hvad er der i denne plante? Det bedste automatiserede system til at finde potentielle stofferDen nye metode til beregningsmæssig massespektrometri vil fremskynde opdagelsen af naturlige produkter, der kunne bruges i medicin. Kredit:Public domain Forskere ved RIKEN Center for Sustainable -
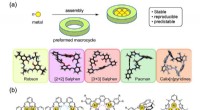 Metalliske komplekser lavet af cykliske molekylerModerne makrocykler brugt til syntese af diskrete polymetalliske komplekser:(a) koncept, (b) kemiske strukturer af repræsentative polymetalliske komplekser. Kredit:Kanazawa University I polymetall
Metalliske komplekser lavet af cykliske molekylerModerne makrocykler brugt til syntese af diskrete polymetalliske komplekser:(a) koncept, (b) kemiske strukturer af repræsentative polymetalliske komplekser. Kredit:Kanazawa University I polymetall -
 Ny metode til konstruktion af metaboliske vejeKredit:CC0 Public Domain Celler er utroligt dygtige til at skabe komplekse molekyler, ligesom terapi, og kan gøre så meget bedre end mange af vores bedste fabrikker. Syntetiske biologer søger at
Ny metode til konstruktion af metaboliske vejeKredit:CC0 Public Domain Celler er utroligt dygtige til at skabe komplekse molekyler, ligesom terapi, og kan gøre så meget bedre end mange af vores bedste fabrikker. Syntetiske biologer søger at -
 3-D-printet smart gel ændrer form, når den udsættes for lysDenne blæksprutte har farveskiftende celler, kaldet kromatoforer, i sin hud, et fænomen, der inspirerede Rutgers ingeniører. Kredit:NOAA Okeanos Explorer Program, Galapagos Rift Expedition 2011 In
3-D-printet smart gel ændrer form, når den udsættes for lysDenne blæksprutte har farveskiftende celler, kaldet kromatoforer, i sin hud, et fænomen, der inspirerede Rutgers ingeniører. Kredit:NOAA Okeanos Explorer Program, Galapagos Rift Expedition 2011 In
- I en løsning, hvilke udtryk bruges til det stof, der opløses, og medium, hvor det opløses?
- Hvilken form findes zink i?
- NASAs Operation IceBridge afslutter 11 års polarundersøgelser
- Undersøgelse samler den første observation af leptonisk henfald D+→ τ+ντ
- Venus:Earths Blazing-hot og Bizarre Twin
- Hvordan overlever man en taktisk atombombe? Forsvarseksperter forklarer


