Hvordan påvirker eddike smeltende is?
* sænkning af frysepunktet: Mens eddike har et lavere frysepunkt end vand, er mængden af eddike, der er nødvendig for at gøre en mærkbar forskel i det frysepunkt for is, betydelig.
* Acidity's rolle: Aciditeten af eddike smelter ikke direkte is. I stedet spiller det en rolle i at nedbryde strukturen af iskrystaller, hvilket gør dem mere modtagelige for smeltning.
* Kemiske reaktioner: Eddike, der er en svag syre, kan reagere med calciumcarbonatet i is (som kommer fra opløste mineraler i vand). Denne reaktion frigiver varme, som hjælper med at smelte isen.
* Salteffekten: Eddike forstyrrer ligesom salt hydrogenbindingen mellem vandmolekyler i is. Denne forstyrrelse gør det lettere for isen at skifte tilbage til flydende vand.
Imidlertid er effekten af eddike på issmeltning generelt mindre udtalt end salt. Dette er fordi:
* lavere koncentration af ioner: Eddike indeholder færre ioner (ladede partikler) end salt. Ioner er de vigtigste drivere for saltens is-smeltende virkning.
* svagere forstyrrelse: Den sure natur af eddike kan forstyrre isstrukturen, men den er ikke så effektiv som de ioniske interaktioner mellem salt ved at forstyrre brintbindingerne.
Kortfattet: Eddike kan fremskynde smeltningen af is, men dens virkning er mindre dramatisk end salt. Aciditeten af eddike spiller en rolle i nedbrydning af isstrukturen, hvilket gør den mere modtagelig for smeltning, men processen er ikke så effektiv som den ioniske forstyrrelse forårsaget af salt.
 Varme artikler
Varme artikler
-
 Betonstrukturenes levetid forlænges med et kulstoftekstil(Venstre) Forringet betonelement og præfabrikeret TRM -panel; og (højre) Betonelement forstærket med TRM -panel. Kredit:Korea Institute of Civil Engineering and Building Technology (KICT) Korea In
Betonstrukturenes levetid forlænges med et kulstoftekstil(Venstre) Forringet betonelement og præfabrikeret TRM -panel; og (højre) Betonelement forstærket med TRM -panel. Kredit:Korea Institute of Civil Engineering and Building Technology (KICT) Korea In -
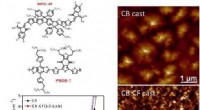 Binær opløsningsmiddelblanding, der øger høj effektivitet af polymersolcellerDe kemiske strukturer af elektrondonor PBDB-T og fluoreret NFA INPIC-4F; J-V karakteristika for PBDB-T:INPIC-4F solceller støbt af forskellige opløsningsmidler; AFM-billederne af PBDB-T:INPIC-4F overf
Binær opløsningsmiddelblanding, der øger høj effektivitet af polymersolcellerDe kemiske strukturer af elektrondonor PBDB-T og fluoreret NFA INPIC-4F; J-V karakteristika for PBDB-T:INPIC-4F solceller støbt af forskellige opløsningsmidler; AFM-billederne af PBDB-T:INPIC-4F overf -
 Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli
Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli -
 Forskere laver bæredygtig polymer af sukkerarter i træDen nye polymer er fremstillet ved hjælp af xylose, et sukker, der findes i træ. Kredit:Leszek Kobusinski Forskere fra University of Bath har lavet en bæredygtig polymer ved at bruge det næstmest
Forskere laver bæredygtig polymer af sukkerarter i træDen nye polymer er fremstillet ved hjælp af xylose, et sukker, der findes i træ. Kredit:Leszek Kobusinski Forskere fra University of Bath har lavet en bæredygtig polymer ved at bruge det næstmest


