Hvad er sandt med alle partikler en gas, der er indkapslet i beholderen?
* konstant tilfældig bevægelse: Gaspartikler er i konstant, tilfældig bevægelse. De bevæger sig i lige linjer, indtil de kolliderer med hinanden eller væggene i beholderen.
* ubetydelige intermolekylære kræfter: De attraktive kræfter mellem gaspartikler er meget svage sammenlignet med partiklernes kinetiske energi. Dette er grunden til, at gasser kan udvide til at fylde enhver beholder.
* Elastiske kollisioner: Kollisioner mellem gaspartikler og beholdervæggene er perfekt elastiske. Dette betyder, at ingen kinetisk energi går tabt under kollisionen.
* Gennemsnitlig kinetisk energi proportional med temperatur: Den gennemsnitlige kinetiske energi for gaspartiklerne er direkte proportional med den absolutte temperatur på gassen. Dette betyder, at varmere gasser har hurtigere bevægende partikler.
* besætter hele bind: Partiklerne af en gas spredes langt fra hinanden, og de bevæger sig frit. Dette giver dem mulighed for at fylde hele volumen på beholderen.
Vigtig note: Dette er generelle egenskaber ved ideelle gasser. Ægte gasser udviser afvigelser fra ideel opførsel, især ved høje tryk og lave temperaturer, hvor intermolekylære kræfter bliver mere markante.
Sidste artikelHvordan kan radioaktive isotoper bruges som sporstoffer?
Næste artikelHvad er et syntese -spørgsmål?
 Varme artikler
Varme artikler
-
 En ny klasse af katalysatorer til miljøvenlige belægningerKredit:Unsplash/CC0 Public Domain Kemikere fra Konstanz har udviklet en ny klasse af katalysatorer, der gør det muligt at fremstille polyethylen-dispersioner direkte i vand. Dette åbner perspektive
En ny klasse af katalysatorer til miljøvenlige belægningerKredit:Unsplash/CC0 Public Domain Kemikere fra Konstanz har udviklet en ny klasse af katalysatorer, der gør det muligt at fremstille polyethylen-dispersioner direkte i vand. Dette åbner perspektive -
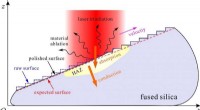 CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem
CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem -
 Bladinspireret overflade forhindrer frostdannelseFrost dannes på de konvekse områder af blade, men ikke på de konkave årer. Kredit:Stephan Herb Forskere fra Northwestern University opdagede en ny måde at reducere frostdannelsen på enhver overfla
Bladinspireret overflade forhindrer frostdannelseFrost dannes på de konvekse områder af blade, men ikke på de konkave årer. Kredit:Stephan Herb Forskere fra Northwestern University opdagede en ny måde at reducere frostdannelsen på enhver overfla -
 Forskere opfinder dyrefri test af dødelige neurotoksinerEn tempelgravhugorm fra Gombak-dalen, Malaysia. Kredit:Scientistchic Dyreforsøg vil ikke længere være påkrævet for at vurdere en gruppe dødelige neurotoksiner, takket være University of Queensland
Forskere opfinder dyrefri test af dødelige neurotoksinerEn tempelgravhugorm fra Gombak-dalen, Malaysia. Kredit:Scientistchic Dyreforsøg vil ikke længere være påkrævet for at vurdere en gruppe dødelige neurotoksiner, takket være University of Queensland
- Droner svæver op til skyer for at forstå effekten af isdannelse på klimaet
- Første af sin slags eksperimentelle beviser trodser konventionelle teorier om, hvordan plasmaer uds…
- Hvad er celler, der ikke er kræft og ikke har nogen indflydelse på helbredet?
- NASA finder tyfonen Prapiroon, der påvirker den koreanske halvø, det sydlige Japan
- Hvor lang er 30 måner?
- Hvad er varmeoverførslen mellem to stoffer?


