Hvorfor gør de ædle gasser ikke let fra forbindelse?
Her er hvorfor:
* fuld ydre skal: Ædle gasser har en fuldstændig fyldt ydre elektronskal. Denne konfiguration er ekstremt stabil, hvilket gør dem tilbageholdende med at vinde eller miste elektroner.
* Høj ioniseringsenergi: Fjernelse af et elektron fra et ædelgasatom kræver en betydelig mængde energi på grund af den stabile elektronkonfiguration. Denne høje ioniseringsenergi gør det vanskeligt for dem at danne positive ioner.
* Lav elektronaffinitet: Noble gasser har en lav elektronaffinitet, hvilket betyder, at de ikke let accepterer yderligere elektroner. Dette skyldes, at deres ydre skal allerede er fuld, og at tilføje flere elektroner ville forstyrre stabiliteten.
Undtagelser:
Mens ædle gasser generelt er ureaktive, er der nogle få undtagelser:
* Xenon -forbindelser: Xenon, den største og mest reaktive af de ædle gasser, danner forbindelser med stærkt elektronegative elementer som fluor og ilt. For eksempel XEF2, XEF4 og XEO3.
* radonforbindelser: Radon er endnu mere reaktiv end Xenon og kan danne forbindelser med ilt, men disse er generelt mindre stabile.
* Argonforbindelser: Argon har vist sig at danne et par ustabile forbindelser, som den meget reaktive ARF.
Kortfattet: De ædle gasseres manglende reaktivitet stammer fra deres stabile, fulde ydre elektronskal, høj ioniseringsenergi og lav elektronaffinitet. De er meget ureaktive under standardbetingelser, men der findes nogle undtagelser med de tungere ædle gasser, især Xenon og Radon.
 Varme artikler
Varme artikler
-
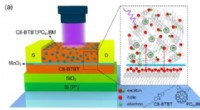 Forskere udvikler ultrafølsomme organiske fototransistorer baseret på en ny hybridlagsarkitekturStrukturen af hybrid-lag fototransistor. Kredit:LI Jia Organiske fototransistorer (OPTer) er meget udbredt i miljø-/sundhedsovervågning, kvantekommunikation, kemisk/biomedicinsk sansning, fjernb
Forskere udvikler ultrafølsomme organiske fototransistorer baseret på en ny hybridlagsarkitekturStrukturen af hybrid-lag fototransistor. Kredit:LI Jia Organiske fototransistorer (OPTer) er meget udbredt i miljø-/sundhedsovervågning, kvantekommunikation, kemisk/biomedicinsk sansning, fjernb -
 Klart og effektivt lys uden sjældne metallerKredit:Mattias Lindh Moderne smartphone -skærme, samt mange andre effektive lyskilder, indeholde dyre og miljøproblematiske sjældne metaller. For en bæredygtig fremtid, ingeniører skal vende sig t
Klart og effektivt lys uden sjældne metallerKredit:Mattias Lindh Moderne smartphone -skærme, samt mange andre effektive lyskilder, indeholde dyre og miljøproblematiske sjældne metaller. For en bæredygtig fremtid, ingeniører skal vende sig t -
 Organopbevaring et skridt nærmere med kryokonserveringIllustration af holdets kryobeskyttelsesmiddel, der hjælper med at beskytte en celle mod beskadigelse under kryokonservering, primært mod dehydrering og frysning ved at forhindre dannelsen af iskrys
Organopbevaring et skridt nærmere med kryokonserveringIllustration af holdets kryobeskyttelsesmiddel, der hjælper med at beskytte en celle mod beskadigelse under kryokonservering, primært mod dehydrering og frysning ved at forhindre dannelsen af iskrys -
 Ny tilgang til fotosyntetisk produktion af kulstofneutralt biobrændstof fra grønne algerKredit:University of Turku Reduktion af CO2 -emissioner for at forhindre klimaændringer kræver udvikling af nye teknologier til bæredygtig og vedvarende biobrændstofproduktion. Molekylær brint bet
Ny tilgang til fotosyntetisk produktion af kulstofneutralt biobrændstof fra grønne algerKredit:University of Turku Reduktion af CO2 -emissioner for at forhindre klimaændringer kræver udvikling af nye teknologier til bæredygtig og vedvarende biobrændstofproduktion. Molekylær brint bet
- Oxider vil reagere med saltsyre, men ikke vandigt natriumhydroxid?
- Graphing Calculator Art: Sådan laver du et Face
- Asien-Stillehavsskælv varsler en katastrofe? Eksperter siger nej
- Hvilke to strukturer hjælper med nåletræer til at reproducere?
- Hvorfor tager vi os tid til at klassificere sagen?
- Kommer til en skærm nær dig:En fejlfri, molekyle-tyk film


