Hvilke af følgende egenskaber minimerer forskelle mellem en ideel gas og en ægte gas?
* Ideelle gasforudsætninger: Den ideelle gasmodel er baseret på flere antagelser, herunder:
* Ingen intermolekylære kræfter: Ideelle gasmolekyler antages at have ingen tiltrækning eller frastødelse mellem dem.
* ubetydelig molekylær volumen: Molekylerne i sig selv betragtes som ubetydelig sammenlignet med beholderens volumen.
* perfekt elastiske kollisioner: Kollisioner mellem molekyler antages at være perfekt elastisk, hvilket betyder, at ingen energi går tabt.
* Ægte gasadfærd: Ægte gasmolekyler har intermolekylære kræfter, og deres volumen er ikke ubetydelig. Ved høje tryk og lave temperaturer bliver disse faktorer mere markante:
* Højt tryk: Ved højt tryk er gasmolekyler tættere sammen, hvilket øger vigtigheden af intermolekylære kræfter.
* Lav temperatur: Ved lave temperaturer har molekyler mindre kinetisk energi, hvilket gør intermolekylære kræfter mere markante.
* minimering af forskelle: Ved at bevæge sig til lavere tryk og højere temperatur:
* lavere tryk: Gasmolekyler er længere fra hinanden, hvilket reducerer påvirkningen af intermolekylære kræfter.
* Højere temperatur: Molekyler har mere kinetisk energi, hvilket gør deres volumen ubetydelig sammenlignet med beholderen og overvinder intermolekylære kræfter.
Ved lavt tryk og høj temperatur vil opførslen af en reel gas derfor nærmeste tilnærme opførslen af en ideel gas.
 Varme artikler
Varme artikler
-
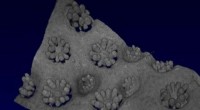 3-D-printede koraller kunne forbedre bioenergien og hjælpe koralreveneKredit:Sarah Collins (Cambridge University) Forskere fra Cambridge University og University of California San Diego har 3-D trykte koralinspirerede strukturer, der er i stand til at vokse tætte po
3-D-printede koraller kunne forbedre bioenergien og hjælpe koralreveneKredit:Sarah Collins (Cambridge University) Forskere fra Cambridge University og University of California San Diego har 3-D trykte koralinspirerede strukturer, der er i stand til at vokse tætte po -
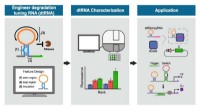 Lille teknik kan bringe store fremskridt inden for lægehjælpOvenstående grafik viser skemaer for en proces, der er central for forskning ledet af Xiao Wang og Alexander Green for at finde nye måder at genoprette menneskers sundhed ved at ombygge kroppens biome
Lille teknik kan bringe store fremskridt inden for lægehjælpOvenstående grafik viser skemaer for en proces, der er central for forskning ledet af Xiao Wang og Alexander Green for at finde nye måder at genoprette menneskers sundhed ved at ombygge kroppens biome -
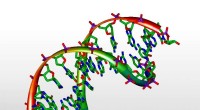 Ved at opdage genetisk materiale, hurtig sensor har potentiel anvendelse som et klinisk værktøj3D-model af DNA. Kredit:Michael Ströck/ Wikimedia/ GNU Free Documentation License På mindre end et sekund, en lille sensor, der bruges i hjernekemiforskning, kan detektere nøglemolekylerne, der gi
Ved at opdage genetisk materiale, hurtig sensor har potentiel anvendelse som et klinisk værktøj3D-model af DNA. Kredit:Michael Ströck/ Wikimedia/ GNU Free Documentation License På mindre end et sekund, en lille sensor, der bruges i hjernekemiforskning, kan detektere nøglemolekylerne, der gi -
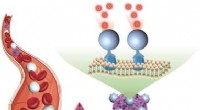 Direkte påvisning af cirkulerende tumorceller i blodprøverKredit:Wiley-VCH Tumorceller, der cirkulerer i blodet, er markører for tidlig opdagelse og prognose af kræft. Imidlertid, påvisning af disse celler er udfordrende på grund af deres knaphed. I jour
Direkte påvisning af cirkulerende tumorceller i blodprøverKredit:Wiley-VCH Tumorceller, der cirkulerer i blodet, er markører for tidlig opdagelse og prognose af kræft. Imidlertid, påvisning af disse celler er udfordrende på grund af deres knaphed. I jour
- Kunne teoretiseret Planet 9 være et oprindeligt sort hul? Forskere foreslår metode til at finde ud…
- Hvordan jasmonatsignalering forbedres under fosformangeltilstande i plantefysiologi
- Orkaner minder os om, at sand ikke er en vedvarende ressource
- Undersøgelse viser, hvordan kulstof nanorør kan påvirke slimhinden i lungerne
- Sådan konverteres hele tal til procentdele
- Hvad sker der med potentiel energi, når man hopper ud af et fly?


