Hvad er reaktionen mellem kaliumchlorat og mangandioxid, når de opvarmes?
reaktionen:
2 KCLO₃ (S) → 2 KCl (S) + 3 O₂ (G)
Forklaring:
* kaliumchlorat (KCLO₃) er en ustabil forbindelse, der nedbrydes, når den opvarmes.
* mangandioxid (MNO₂) fungerer som en katalysator , der fremskynder nedbrydningsprocessen, men ikke fortæres sig selv.
* Nedbrydningen producerer kaliumchlorid (KCL) , et fast salt og iltgas (O₂) .
Nøglepunkter:
* katalysator: Mangandioxid sænker den aktiveringsenergi, der kræves til nedbrydning af kaliumchlorat. Dette betyder, at reaktionen sker hurtigere ved en lavere temperatur.
* Oxygenproduktion: Reaktionen er en primær kilde til iltgas i laboratoriet. Oxygengassen frigøres som bobler og kan opsamles ved forskydning af vand.
* sikkerhed: Denne reaktion er meget eksoterm (producerer varme) og kan være farlig, hvis den ikke håndteres korrekt. Det er vigtigt at bruge passende sikkerhedsforholdsregler og for at sikre, at reaktionen udføres i et kontrolleret miljø.
Mangandioxidens rolle:
Mno₂ fungerer som en katalysator ved at tilvejebringe en overflade til nedbrydningsreaktionen at forekomme lettere. Det gør dette af:
* sænkning af aktiveringsenergi: Det giver en alternativ reaktionsvej med en lavere aktiveringsenergi, der gør det muligt at nedbryde nedbrydningen hurtigere.
* Tilvejebringelse af steder til iltadsorption: Mno₂ kan adsorbere oxygenatomer, der letter nedbrydningen af kaliumchlorat.
Kortfattet: Opvarmning af kaliumchlorat i nærvær af mangandioxid resulterer i en hurtig nedbrydning, frigiver iltgas og forlader kaliumchlorid som en fast rest. Denne reaktion er et vigtigt eksempel på katalyse og er vidt brugt i laboratorieindstillinger.
 Varme artikler
Varme artikler
-
 Belysning af bittesmå proteiner i levende celler ved hjælp af enkelt-rest mærkningsmærkerUniverselle enkelt-rest-terminalmærker til fluorescerende levende celle-billeddannelse af mikroproteiner. Kredit:Simon Elsasser SciLifeLab Fellow Simon Elsässer laboratorium ved Karolinska Institu
Belysning af bittesmå proteiner i levende celler ved hjælp af enkelt-rest mærkningsmærkerUniverselle enkelt-rest-terminalmærker til fluorescerende levende celle-billeddannelse af mikroproteiner. Kredit:Simon Elsasser SciLifeLab Fellow Simon Elsässer laboratorium ved Karolinska Institu -
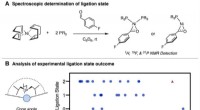 Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt
Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt -
 Forskere holder sig til edderkoppesilke for et bionedbrydeligt alternativ til traditionel limKredit:Pixabay/CC0 Public Domain Forskere har med succes produceret syntetisk edderkoppesilke for at skabe et nyt bionedbrydeligt limalternativ. De Manchester University-baserede forskere fandt u
Forskere holder sig til edderkoppesilke for et bionedbrydeligt alternativ til traditionel limKredit:Pixabay/CC0 Public Domain Forskere har med succes produceret syntetisk edderkoppesilke for at skabe et nyt bionedbrydeligt limalternativ. De Manchester University-baserede forskere fandt u -
 Et spring i at bruge silicium til batterianoderSiliciummikrosfærer har ekstraordinær mekanisk styrke på grund af tilsætning af kulnanorør, der får kuglerne til at ligne garnkugler. I denne repræsentation, billedet til venstre illustrerer et nærbil
Et spring i at bruge silicium til batterianoderSiliciummikrosfærer har ekstraordinær mekanisk styrke på grund af tilsætning af kulnanorør, der får kuglerne til at ligne garnkugler. I denne repræsentation, billedet til venstre illustrerer et nærbil
- Disse enorme sprang af energi fra atmosfæren kan påvirke radioverførsler og vejrforhold på jorde…
- Hvilken tektonisk plade er Puyehue -vulkanen på?
- Kæmpeplaneter omkring unge stjerne rejser spørgsmål om, hvordan planeter dannes
- Top EPA-rådgivere udfordrer mangeårig luftforureningsvidenskab, truer amerikanernes helbred
- Er kaustisk soda fra en naturlig kilde?
- Hvilken har infrarød lys eller gammastråler med højere energi?


