Forklar elektrolyse af vand med hjælpediagrammet?
Elektrolyse af vand:En visuel guide
Hvad er elektrolyse?
Elektrolyse er processen med at bruge en elektrisk strøm til at drive en ikke-spontan kemisk reaktion. I tilfælde af vand nedbryder elektrolyse vand (H₂O) i dets komponentelementer:brint (H₂) og ilt (O₂).
Opsætningen:
1. elektrolytisk celle: Dette er en beholder, der indeholder den løsning, der skal elektrolyses.
2. Elektroder: To elektroder (normalt lavet af inerte metaller som platin eller grafit) er nedsænket i opløsningen.
3. DC strømkilde: En jævnstrøm (DC) strømkilde giver den elektriske energi til reaktionen.
Processen:
1. forbindelse: Elektroderne er forbundet til de positive (+) og negative (-) terminaler for DC-strømkilden.
2. elektrolyt: Vandopløsningen indeholder en lille mængde elektrolyt (som svovlsyre eller natriumhydroxid) for at forbedre ledningsevnen.
3. reaktion ved katoden (negativ elektrode): Hydrogenioner (H+) fra vandet tiltrækkes af den negativt ladede katode. De får elektroner og danner brintgas (H₂), der frigøres som bobler ved katoden.
4. reaktion ved anoden (positiv elektrode): Hydroxidioner (OH-) fra vandet tiltrækkes af den positivt ladede anode. De mister elektroner og danner iltgas (O₂), der frigives som bobler ved anoden.
diagram:
! [Elektrolyse af vanddiagram] (https://upload.wikimedia.org/wikipedia/commons/thumb/a/a6/electrolysis_of_water.svg/640px-electrolysis_of_water.svg.png)
Sammendrag af reaktionerne:
* katode: 2H⁺ + 2E⁻ → H₂
* anode: 4OH⁻ → 2H₂O + O₂ + 4E⁻
Den samlede reaktion:
2H₂O → 2H₂ + O₂
Nøglepunkter:
* Elektrolyse af vand kræver en DC -strømkilde.
* Mængden af produceret brintgas er dobbelt så meget mængden af iltgas.
* Elektrolyse er en proces, der bruges til at producere ren brintgas, der bruges i brændselsceller og andre anvendelser.
Bemærk: Dette er en forenklet forklaring. Den faktiske proces er mere kompleks og involverer forskellige faktorer som koncentrationen af elektrolytten, elektrodematerialet og den påførte spænding.
Sidste artikelHvilken type gas udgør naturgas?
Næste artikelHvordan reagerer helium med kulilte?
 Varme artikler
Varme artikler
-
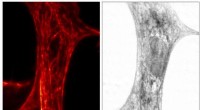 Kombineret røntgen- og fluorescensmikroskop afslører usete molekylære detaljerSTED-billede (venstre) og røntgenbillede (højre) af den samme hjertevævscelle fra en rotte. For STED, netværket af actin filamenter i cellen, hvilket er vigtigt for cellens mekaniske egenskaber, er bl
Kombineret røntgen- og fluorescensmikroskop afslører usete molekylære detaljerSTED-billede (venstre) og røntgenbillede (højre) af den samme hjertevævscelle fra en rotte. For STED, netværket af actin filamenter i cellen, hvilket er vigtigt for cellens mekaniske egenskaber, er bl -
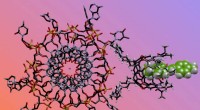 Kemisk næse opsnuser kritiske forskelle i DNA-strukturerIllustration af den kemiske næse, der registrerer en G-quadruplex struktur. Kredit:Richard Hooley/UCR Små ændringer i strukturen af DNA er blevet impliceret i brystkræft og andre sygdomme, men d
Kemisk næse opsnuser kritiske forskelle i DNA-strukturerIllustration af den kemiske næse, der registrerer en G-quadruplex struktur. Kredit:Richard Hooley/UCR Små ændringer i strukturen af DNA er blevet impliceret i brystkræft og andre sygdomme, men d -
 Fremskridt inden for cellulosebaseret fødevareemballage går videre til testfasen af industriel p…Kredit:Pixabay/CC0 Public Domain VTT tester Thermocell -plastfilm fremstillet af cellulose og fedtsyrer i produktionen af mademballage i samarbejde med Arla Foods, Paulig, og Wipak. Termocelle p
Fremskridt inden for cellulosebaseret fødevareemballage går videre til testfasen af industriel p…Kredit:Pixabay/CC0 Public Domain VTT tester Thermocell -plastfilm fremstillet af cellulose og fedtsyrer i produktionen af mademballage i samarbejde med Arla Foods, Paulig, og Wipak. Termocelle p -
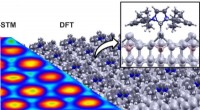 Ny metode til molekylær funktionalisering af overfladerSammenligning af den teoretisk beregnede struktur (DFT, til højre) af det bestilte NHC -enkeltlag med det eksperimentelle scanningstunnelmikroskopibillede (STM, venstre). N:nitrogenatom, C:carbonatom,
Ny metode til molekylær funktionalisering af overfladerSammenligning af den teoretisk beregnede struktur (DFT, til højre) af det bestilte NHC -enkeltlag med det eksperimentelle scanningstunnelmikroskopibillede (STM, venstre). N:nitrogenatom, C:carbonatom,
- Udnyttelse af potentialet i sociale medier og crowdsourcing til bedre katastrofemodstandsdygtighed i…
- Sådan beregnes en T-score
- Leonardo da Vincis mor kunne have været en slave. Her er, hvad opdagelsen afslører om renæssancen…
- Hvad fortæller slogans ved demonstrationer os?
- Bifunktionelle CoFeP-N nanotråde syntetiseret til bæredygtig vandopdeling
- Styrer hvor hurtigt grafen afkøles


