Er forholdet mellem temperatur og opløselighed det samme for Epsom -salt?
Her er hvorfor:
* de fleste salte: For de fleste ioniske forbindelser øges opløseligheden med stigende temperatur. Dette skyldes, at den tilsatte energi fra varme hjælper med at bryde bindingerne, der holder ionerne sammen i krystalgitteret, hvilket giver dem mulighed for at opløses lettere.
* Epsom salt (MGSO4): Epsom salt udstiller retrograd opløselighed . Dette betyder, at dens opløselighed * falder * med stigende temperatur.
Forklaring på retrograd opløselighed:
* Hydrering: Magnesiumsulfat danner hydratiserede salte, hvilket betyder, at vandmolekyler binder til MGSO4 -molekylerne.
* ligevægt: Opløsningen af MGSO4 er en ligevægtsproces:
MGSO4 (S) + H2O (L) ⇌ MG2 + (AQ) + SO42- (AQ)
* Temperatureffekt: Når temperaturen stiger, skifter ligevægten til venstre (mod den faste MGSO4). Dette skyldes, at de hydratiserede magnesiumsulfationer mister nogle af deres vandmolekyler på grund af øget termisk energi, hvilket fører til et fald i opløselighed.
Kortfattet:
* de fleste salte: Opløselighed øges med temperaturen.
* Epsom salt (MGSO4): Opløselighed falder med temperatur (retrograd opløselighed).
Denne opførsel gør Epsom -salt unik og er et interessant eksempel på, hvordan temperatur kan påvirke opløseligheden på forskellige måder for forskellige forbindelser.
Sidste artikelHvilke 2 ting produceres i slutningen af fotosynteseprocessen?
Næste artikelHvad er kemisk formel af metan og argon?
 Varme artikler
Varme artikler
-
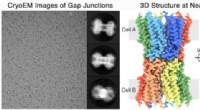 At låse op for hemmelighederne om, hvordan celler kommunikerer, giver indsigt i behandling af sygdo…2-D billeder, venstre, og 3D-strukturen, ret, af gap junction kommunikationskanalen fra øjenlinsen, løst til nær-atomisk opløsning af Reichow Lab ved hjælp af kryo-elektronmikroskopi Kredit:Reichow La
At låse op for hemmelighederne om, hvordan celler kommunikerer, giver indsigt i behandling af sygdo…2-D billeder, venstre, og 3D-strukturen, ret, af gap junction kommunikationskanalen fra øjenlinsen, løst til nær-atomisk opløsning af Reichow Lab ved hjælp af kryo-elektronmikroskopi Kredit:Reichow La -
 Forskere håber, at en robo-næse kunne give K-9-officerer en pauseGolden retriever Rudy, iført militærhundeskilte og et amerikansk flag, bliver trænet af den amerikanske hær til at bruge sin fantastiske næse til at finde menneskelige rester. Kredit:Hærens foto H
Forskere håber, at en robo-næse kunne give K-9-officerer en pauseGolden retriever Rudy, iført militærhundeskilte og et amerikansk flag, bliver trænet af den amerikanske hær til at bruge sin fantastiske næse til at finde menneskelige rester. Kredit:Hærens foto H -
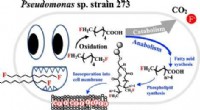 En naturligt forekommende jordbakterie kan give en løsning på evige kemikalierGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c01454 University of Tennessee, Knoxville-fakultetets medlemmer Shawn Campagna, professor og associeret afdel
En naturligt forekommende jordbakterie kan give en løsning på evige kemikalierGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c01454 University of Tennessee, Knoxville-fakultetets medlemmer Shawn Campagna, professor og associeret afdel -
 Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik
Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik


