Hvor mange molekyler vand kan produceres ved reaktionen 2,16 mol ilt med overskydende ethylen.?
1. Skriv den afbalancerede kemiske ligning:
C₂H₄ + 3O₂ → 2CO₂ + 2H₂O
2. Bestem molforholdet:
Fra den afbalancerede ligning ser vi, at 3 mol ilt (O₂) reagerer på produktion af 2 mol vand (H₂O).
3. Beregn molen af produceret vand:
* Vi har 2,16 mol ilt.
* Ved hjælp af molforholdet kan vi oprette en andel:
(2 mol H₂O / 3 mol o₂) =(x mol H₂O / 2,16 mol O₂)
* Løsning til x:x =(2 * 2,16) / 3 =1,44 mol H₂O
4. Konverter mol vand til molekyler:
* Avogadros nummer fortæller os, at der er 6,022 x 10²³ molekyler i en mol.
* Multiplicer molen af vand med Avogadros nummer:
1,44 mol H₂O * (6,022 x 10²³ Molekyler/mol) =8,67 x 10²³ Molekyler af H₂O
Derfor kan 2,16 mol ilt producere 8,67 x 10²³ molekyler vand.
 Varme artikler
Varme artikler
-
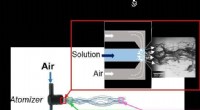 Forskere producerer filamenter og fibre tre gange finere end et menneskehårBeskrivelse af produktionen af PEG-fibre med de Flow Blurring-forstøvere, der blev brugt i undersøgelsen. Kredit:University of Sevilla En gruppe forskere fra Higher Technical School of Engineeri
Forskere producerer filamenter og fibre tre gange finere end et menneskehårBeskrivelse af produktionen af PEG-fibre med de Flow Blurring-forstøvere, der blev brugt i undersøgelsen. Kredit:University of Sevilla En gruppe forskere fra Higher Technical School of Engineeri -
 3-D-printede polymerstents vokser med pædiatriske patienter og nedbrydes biologisk over tidKredit:Mary Ann Liebert, Inc., forlag En ny undersøgelse demonstrerer proof-of-concept for at kombinere computerdesign og simuleringsværktøjer med 3D-printteknologi for at producere selv-ekspander
3-D-printede polymerstents vokser med pædiatriske patienter og nedbrydes biologisk over tidKredit:Mary Ann Liebert, Inc., forlag En ny undersøgelse demonstrerer proof-of-concept for at kombinere computerdesign og simuleringsværktøjer med 3D-printteknologi for at producere selv-ekspander -
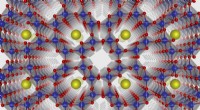 Større end summen af dets deleArgonne-forskere kombinerer eksisterende teorier for at danne en mere generel teori om elektrokemi, der forudsiger uforklarlig adfærd. At gøre dette, forskerne studerede først alfa-manganoxid (vist he
Større end summen af dets deleArgonne-forskere kombinerer eksisterende teorier for at danne en mere generel teori om elektrokemi, der forudsiger uforklarlig adfærd. At gøre dette, forskerne studerede først alfa-manganoxid (vist he -
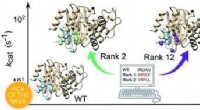 Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre
Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre
- Det er ikke vibranium eller proto-adamantium, men forskeres nye legering kommer tæt på
- 150 millioner år gammelt havmonsterfossil fundet i Polen
- Hvilken diameter på Mælkevejen i fødderne?
- Undersøgelse tyder på, at solenergi er en god mulighed for bjergrige schweiziske regioner
- Hvorfor er de hotteste steder i nærheden af Ækvator?
- Hvad er Latitude and Longitude of Matterhorn?


