Hvad er gassens tendens til at sprede sig tyndt ud?
Her er en sammenbrud:
* diffusion: Bevægelsen af partikler fra en region med høj koncentration til en region med lav koncentration. Denne bevægelse opstår, fordi gasmolekyler er i konstant tilfældig bevægelse.
* tyndt: Dette henviser til det faktum, at gasmolekyler spreder sig for at besætte hele den plads, der er til rådighed for dem. De klumper sig ikke sammen som væsker eller faste stoffer.
Her er nogle nøglefaktorer, der bidrager til denne tendens:
* høj kinetisk energi: Gasmolekyler har høj kinetisk energi, hvilket betyder, at de konstant bevæger sig og kolliderer med hinanden og væggene i deres beholder.
* svage intermolekylære kræfter: Gasmolekyler har svage attraktive kræfter mellem dem, så de kan bevæge sig frit og uafhængigt.
* store afstande mellem molekyler: Gasmolekyler er langt fra hinanden sammenlignet med væsker eller faste stoffer, hvilket fører til mindre interaktion og mere plads til at sprede sig.
Fortæl mig, hvis du gerne vil vide mere om diffusion eller gasegenskaber!
Sidste artikelEr der en ændring i form, der indikerer kemisk ændring?
Næste artikelHvad frigives under nukleare reaktioner?
 Varme artikler
Varme artikler
-
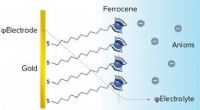 Kombineret tilgang til sondering af grænsefladeelektrokemi mere detaljeretFigur 1:Skematisk af et elektrokemisk aktivt ferrocen-termineret selvsamlet monolag på guld, som blev brugt som en model elektrokemisk grænseflade. Det elektrokemiske miljø illustreres af den potentie
Kombineret tilgang til sondering af grænsefladeelektrokemi mere detaljeretFigur 1:Skematisk af et elektrokemisk aktivt ferrocen-termineret selvsamlet monolag på guld, som blev brugt som en model elektrokemisk grænseflade. Det elektrokemiske miljø illustreres af den potentie -
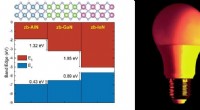 Kraftigt tidligt lys af LED'erForskere bruger supercomputere til at få indsigt i nye materialer, der kan gøre LED-belysning endnu lysere og mere overkommelig. Der er fundet nye egenskaber i kubiske III-nitrider LED-materialer, der
Kraftigt tidligt lys af LED'erForskere bruger supercomputere til at få indsigt i nye materialer, der kan gøre LED-belysning endnu lysere og mere overkommelig. Der er fundet nye egenskaber i kubiske III-nitrider LED-materialer, der -
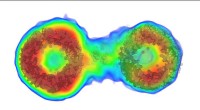 Kraftfuld ny billeddannelsesmetode afslører i detaljer, hvordan partikler bevæger sig i opløsningTakket være den nye metode, dette billede af et biomolekyle afslører dets indviklede indre struktur i orange, rød og gul. Indtil nu, forskere ville kun have kunnet se den blå kontur. Kredit: Naturens
Kraftfuld ny billeddannelsesmetode afslører i detaljer, hvordan partikler bevæger sig i opløsningTakket være den nye metode, dette billede af et biomolekyle afslører dets indviklede indre struktur i orange, rød og gul. Indtil nu, forskere ville kun have kunnet se den blå kontur. Kredit: Naturens -
 Forlænger levetiden for polymerelektrolytbrændselsceller med en nanodisperseret ionomerSkema af Nafion-ionomerer på katalysatoroverfladerne. (A) Fordeling af konventionelle ionomerer syntetiseret ved emulsionspolymerisation. (B) Fordeling af laboratoriefremstillede ionomerer syntetisere
Forlænger levetiden for polymerelektrolytbrændselsceller med en nanodisperseret ionomerSkema af Nafion-ionomerer på katalysatoroverfladerne. (A) Fordeling af konventionelle ionomerer syntetiseret ved emulsionspolymerisation. (B) Fordeling af laboratoriefremstillede ionomerer syntetisere
- Hvordan er landskab med faldet af Icarus og Mus Eacutee des Beaux Arts forskellige?
- Facebook står over for Australiens erstatningskrav for databrud
- Modellering af COVID-19-data skal udføres med ekstrem forsigtighed, siger videnskabsmænd
- Hvor mange sekunder er der i en soldag?
- Er Andromeda Core of Moon?
- Hvordan adskiller du svovlpulver?


