Hvad er sværere at komprimere gasvæske eller fast?
* faste stoffer: I faste stoffer er molekylerne tæt pakket sammen og har meget lidt fri plads mellem dem. De stærke intermolekylære kræfter holder molekylerne stive bundet. Påføring af tryk får simpelthen molekylerne til at skubbe mod hinanden, hvilket er meget vanskeligt at overvinde.
* væsker: Væsker er mere komprimerbare end faste stoffer, fordi deres molekyler er mere løst pakket, hvilket giver mulighed for en lille reduktion i mellemrummet mellem dem, når der påføres tryk.
* Gasser: Gasser er de nemmeste at komprimere, fordi deres molekyler er meget langt fra hinanden og har svage intermolekylære kræfter. Når der påføres tryk, skubbes molekylerne tættere sammen, hvilket reducerer volumenet markant.
Tænk på det sådan:
* fast: Forestil dig en tæt pakket kasse med appelsiner. Du kan ikke nemt klemme flere appelsiner ind.
* væske: Forestil dig en pose med kugler. Du kan trykke på nogle af kuglerne tættere sammen, men ikke så meget som med en gas.
* gas: Forestil dig et værelse fuld af balloner. Du kan nemt komprimere luften i rummet ved at presse ballonerne tættere sammen.
Sidste artikelHvilken type stof fungerer ledning bedst i?
Næste artikelHvilken videnskabelig forklaring nedenfor beskriver bedst en polymer?
 Varme artikler
Varme artikler
-
 Planteforsvarslaget har uventet effekt på flygtige forbindelser, undersøgelse finderNatalia Dudareva og kolleger fandt ud af, at neglebåndet af petunia-blomster fungerer som en vask for flygtige forbindelser. I stedet for at udsende flere af disse forbindelser, når neglebåndet er tyn
Planteforsvarslaget har uventet effekt på flygtige forbindelser, undersøgelse finderNatalia Dudareva og kolleger fandt ud af, at neglebåndet af petunia-blomster fungerer som en vask for flygtige forbindelser. I stedet for at udsende flere af disse forbindelser, når neglebåndet er tyn -
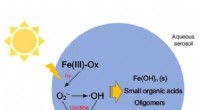 Virkninger af Fenton-lignende reaktioner af ferroloxalat på atmosfæriske oxidationsprocesser og st…Methacrolein reagerer med superoxidradikaler frembragt ved en Fenton-lignende reaktion. Dette påvirker atmosfærisk strålingsforcerende kraft på grund af dannelsen af uopløseligt jernhydroxid. Kredit
Virkninger af Fenton-lignende reaktioner af ferroloxalat på atmosfæriske oxidationsprocesser og st…Methacrolein reagerer med superoxidradikaler frembragt ved en Fenton-lignende reaktion. Dette påvirker atmosfærisk strålingsforcerende kraft på grund af dannelsen af uopløseligt jernhydroxid. Kredit -
 En corny løsning til at hjælpe med at bekæmpe spredningen af den nye coronavirusKarakteristisk for denne håndsprit kommer fra dens ethanolbase. Ethanol er en plantebaseret vedvarende energikilde-i USA primært fremstillet af majs-der ofte blandes med benzin til køretøjer. Kredit:U
En corny løsning til at hjælpe med at bekæmpe spredningen af den nye coronavirusKarakteristisk for denne håndsprit kommer fra dens ethanolbase. Ethanol er en plantebaseret vedvarende energikilde-i USA primært fremstillet af majs-der ofte blandes med benzin til køretøjer. Kredit:U -
 Hvordan klor stabiliserer næste generations solceller på atomare skalaDr. Afshan Jamshaid fremviser perovskit-solceller. Perovskitlaget er klemt i midten mellem andre funktionelle lag af solcellen. Kredit:Okinawa Institute of Science and Technology Graduate University
Hvordan klor stabiliserer næste generations solceller på atomare skalaDr. Afshan Jamshaid fremviser perovskit-solceller. Perovskitlaget er klemt i midten mellem andre funktionelle lag af solcellen. Kredit:Okinawa Institute of Science and Technology Graduate University


