Er eddikesyreanhydrid en syre eller en base?
* Brønsted-Lowry Definition: Syrer donerer protoner (H+) og baser accepterer protoner. Deketisk anhydrid donerer ikke let protoner.
* Lewis Definition: Syrer accepterer elektronpar, og baser donerer elektronpar. Mens eddikesyreanhydrid kan reagere med nukleofile (elektronpardonorer), er det ikke en stærk Lewis -syre.
Dog har eddikesyreanhydrid sure egenskaber i en bestemt sammenhæng:
* Hydrolyse: Når eddikesyreanhydrid reagerer med vand, danner det to molekyler af eddikesyre. Denne reaktion producerer H+ -ioner, hvilket gør opløsningen sur.
Key Takeaway: Deketisk anhydrid i sig selv er ikke en syre eller base, men dets reaktion med vand producerer sure forhold.
Sidste artikelHvilken proces i vandcyklussen ændrer væske til damp?
Næste artikelEt solidt, der sætter sig ud af opløsningen, kaldes?
 Varme artikler
Varme artikler
-
 Forskere afslører hemmeligheden bag materiale til lovende infrarøde kameraerBolometer. Kredit:Daria Sokol/MIPT Forskere fra Moskva Institut for Fysik og Teknologi og RAS Institute for Theoretical and Applied Electromagnetics har opdaget, hvad der får vanadiumdioxidfilm ti
Forskere afslører hemmeligheden bag materiale til lovende infrarøde kameraerBolometer. Kredit:Daria Sokol/MIPT Forskere fra Moskva Institut for Fysik og Teknologi og RAS Institute for Theoretical and Applied Electromagnetics har opdaget, hvad der får vanadiumdioxidfilm ti -
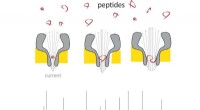 Nanoporer gør det bærbare massespektrometer til peptider til virkelighedEt peptid kommer ind i den tynde ende af nanoporen, og der ændrer strømmen i forhold til dens masse. Ved at bruge forskellig størrelse nanoporer, en række peptidstørrelser kan måles. Kredit:G. Maglia
Nanoporer gør det bærbare massespektrometer til peptider til virkelighedEt peptid kommer ind i den tynde ende af nanoporen, og der ændrer strømmen i forhold til dens masse. Ved at bruge forskellig størrelse nanoporer, en række peptidstørrelser kan måles. Kredit:G. Maglia -
 Forskere skaber lokkemaling, der lurer infrarøde kameraerBogstaverne C-A-L fremstår seje, selvom miljøet er varmt. UC Berkeley -ingeniører udvikler et lokkedue, der lader infrarøde kameraer til at opfatte en bestemt temperatur frem for objektets faktiske te
Forskere skaber lokkemaling, der lurer infrarøde kameraerBogstaverne C-A-L fremstår seje, selvom miljøet er varmt. UC Berkeley -ingeniører udvikler et lokkedue, der lader infrarøde kameraer til at opfatte en bestemt temperatur frem for objektets faktiske te -
 Oprettelse af lithium-ion-batterier med højere energitæthed til vedvarende energianvendelserI den Journal of Vacuum Science and Technology A , forskere undersøger oprindelsen af nedbrydning i LIB-katodematerialer med høj energitæthed og udvikler strategier til at afbøde disse nedbrydning
Oprettelse af lithium-ion-batterier med højere energitæthed til vedvarende energianvendelserI den Journal of Vacuum Science and Technology A , forskere undersøger oprindelsen af nedbrydning i LIB-katodematerialer med høj energitæthed og udvikler strategier til at afbøde disse nedbrydning
- Hvor er proteiner produceret af i cellen?
- UTA ingeniør til at bygge en enhed til at fange tabt varmeenergi
- Naturvidenskabelige Projekter og Idéer på Art
- Sikker måde at opløse Paper
- Hvad kaldes cellens kraftcelle, og det er involveret i energiproduktion til celle?
- Cadmium:Det meget giftige metal, der driver verden


