Hvad indeholder vandmolekyler og brintbindingerne mellem forklarer de fleste af livsstøttende egenskaber?
Her er hvorfor:
* Vandmolekyler: Vand (H₂O) er sammensat af to hydrogenatomer og et iltatom. Disse atomer er forbundet med kovalente bindinger, som er stærke og deler elektroner.
* Hydrogenbindinger: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (nær hydrogenerne) og en lidt negativ ende (nær ilt). Denne polaritet tillader vandmolekyler at danne svage bindinger kaldet brintbindinger med hinanden. Disse obligationer er svagere end kovalente obligationer, men de er stadig vigtige.
* livsstøttende egenskaber: De unikke egenskaber ved vand, der understøtter livet, skyldes stort set hydrogenbindingerne mellem vandmolekyler:
* Høj varmekapacitet: Vand kan absorbere en masse varmeenergi, før dens temperatur øges markant. Dette hjælper med at regulere temperaturen på organismer og miljøet.
* høj fordampningsvarme: Vand kræver en masse energi for at skifte fra en væske til en gas (fordampning). Dette hjælper organismer med at køle ned gennem sved.
* Fremragende opløsningsmiddel: Water's polaritet giver det mulighed for at opløse mange stoffer, hvilket gør det til et ideelt medium til kemiske reaktioner i levende organismer.
* samhørighed og vedhæftning: Hydrogenbindinger giver vand dets sammenhængende (hold sammen) og klæbende (hold dig til andre overflader) egenskaber. Dette gør det muligt for vand at bevæge sig gennem planter og dyr.
* densitet: Vand er mindre tæt som en fast (is) end som en væske. Dette betyder, at is flyder, hvilket er vigtigt for akvatisk liv.
Sammenfattende er Water's evne til at danne brintbindinger nøglen til dets unikke egenskaber, der gør det vigtigt for livet.
Sidste artikelHvordan udøver gas pres på siden af sin beholder?
Næste artikelHvilke elemnt har 2 elektroner neutrale atomer?
 Varme artikler
Varme artikler
-
 vridning, fleksible krystaller nøglen til solenergiproduktionEn vigtig bidragyder til, hvordan disse halogenidperovskitter skaber og transporterer elektricitet, hænger bogstaveligt talt på den måde, hvorpå deres oktaedriske atomgitter vrider og drejer på en hæn
vridning, fleksible krystaller nøglen til solenergiproduktionEn vigtig bidragyder til, hvordan disse halogenidperovskitter skaber og transporterer elektricitet, hænger bogstaveligt talt på den måde, hvorpå deres oktaedriske atomgitter vrider og drejer på en hæn -
 Metabolisk aktivitet af brunt fedtvæv lettere at verificere med ny metodeDen nye lasermetode MSOT repræsenterer brunt fedt. Kredit:Reber/ TUM Brunt fedtvæv har spillet en nøglerolle i forebyggelsesforskning, siden dets tilstedeværelse først blev dokumenteret hos voksne
Metabolisk aktivitet af brunt fedtvæv lettere at verificere med ny metodeDen nye lasermetode MSOT repræsenterer brunt fedt. Kredit:Reber/ TUM Brunt fedtvæv har spillet en nøglerolle i forebyggelsesforskning, siden dets tilstedeværelse først blev dokumenteret hos voksne -
 Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer
Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer -
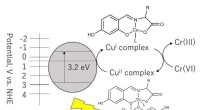 Reduktion ved reduktion:Ny tilgang til at afbøde chromforurening i spildevandChromforurening i spildevand kan afbødes ved at omdanne Cr(VI) til Cr(III) gennem en fotokemisk reaktion, der involverer kobberkomplekser. Kredit:Takashiro Akitsu, Tokyos Videnskabsuniversitet Gru
Reduktion ved reduktion:Ny tilgang til at afbøde chromforurening i spildevandChromforurening i spildevand kan afbødes ved at omdanne Cr(VI) til Cr(III) gennem en fotokemisk reaktion, der involverer kobberkomplekser. Kredit:Takashiro Akitsu, Tokyos Videnskabsuniversitet Gru
- Design af en fritstående, superladet polypeptid-proton-ledende membran
- Hvor mange miles er 1375 meter?
- Hvad er den sammenføjning af en mandlig reproduktiv celle med kvindelig celle?
- Ny undersøgelse viser stressreaktion i realtid på racisme
- Hvilke strukturer passerer vand for at gå fra rødderne?
- Hvordan 'vinder- og tabereffekter' påvirker social rangering hos dyr - og mennesker


