Hvorfor kobber 2 sulfat udfører ikke elektricitet i fast tilstand?
* ionisk struktur: Kobber (II) sulfat er en ionisk forbindelse, hvilket betyder, at den er sammensat af positivt ladede kobberioner (Cu²⁺) og negativt ladede sulfationer (SO₄²⁻). Disse ioner holdes sammen i en stiv, krystallinsk gitter af stærke elektrostatiske kræfter.
* Ingen gratis opladningsbærere: I fast tilstand er ionerne fastgjort i deres positioner inden for krystalgitteret. De kan ikke bevæge sig frit, så der er ingen mobilafgiftsselskaber til rådighed til at bære en elektrisk strøm.
Kontrast dette med den smeltede eller opløste tilstand:
* smeltet tilstand: Når kobber (II) sulfat smeltes, bryder de ioniske bindinger, og ionerne bliver frie til at bevæge sig. Dette muliggør bevægelse af ladningsbærere og derfor elektrisk ledningsevne.
* opløst tilstand: I en vandig opløsning dissocierer kobber (II) sulfat i dets ioner (Cu²⁺ og SO₄²⁻), som er fri til at bevæge sig gennem opløsningen. Denne bevægelse af ioner muliggør elektrisk ledningsevne.
Kortfattet: Fraværet af frie ladningsbærere i den faste tilstand af kobber (II) sulfat er grunden til dets manglende elektrisk ledningsevne. Ionerne er låst i en fast position inden for den krystallinske struktur og forhindrer strømmen af elektricitet.
Sidste artikelHvilke stoffer og kemikalier er involveret i drivhusgasser?
Næste artikelHvad gør nitrogen og brint kemisk blandet sammen?
 Varme artikler
Varme artikler
-
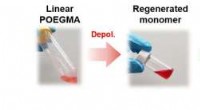 Nedbrydning af plast i dets bestanddeleMonomerer udvindes fra en polymer for at producere et nyt produkt, der igen kan nedbrydes til dets byggesten. Kredit:Wang HS et al., JASC, 2022 Et team af ETH-forskere ledet af Athina Anastasaki er
Nedbrydning af plast i dets bestanddeleMonomerer udvindes fra en polymer for at producere et nyt produkt, der igen kan nedbrydes til dets byggesten. Kredit:Wang HS et al., JASC, 2022 Et team af ETH-forskere ledet af Athina Anastasaki er -
 Forskere laver verdens mindste sammenkædede kæderForskere opdagede en måde at fremstille små sammenlåsende kæder (højre, med kemiske formler til venstre) med sløjfer hver kun en nanometer på tværs. Kredit:Peter Allen I årtier, videnskabsmænd har
Forskere laver verdens mindste sammenkædede kæderForskere opdagede en måde at fremstille små sammenlåsende kæder (højre, med kemiske formler til venstre) med sløjfer hver kun en nanometer på tværs. Kredit:Peter Allen I årtier, videnskabsmænd har -
 Nedbrydelig ligninbaseret polyurethanadsorbent til effektiv oprensning af råolieGrafisk abstrakt. Kredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.128956 En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (
Nedbrydelig ligninbaseret polyurethanadsorbent til effektiv oprensning af råolieGrafisk abstrakt. Kredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.128956 En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering ( -
 Kraftværker drevet af lysKredit:CC0 Public Domain Grønne planter, alger og nogle bakterier bruger sollys til at omdanne energi. Pigmenterne i klorofyl absorberer elektromagnetisk stråling, som fremkalder kemiske reaktione
Kraftværker drevet af lysKredit:CC0 Public Domain Grønne planter, alger og nogle bakterier bruger sollys til at omdanne energi. Pigmenterne i klorofyl absorberer elektromagnetisk stråling, som fremkalder kemiske reaktione
- Hvordan sorterer man væsker efter pH?
- Hvilke to personer er krediteret for at opdage formen på DNA?
- Kvantemekaniske simuleringer af jordens lavere kappemineraler
- Gå dybt:Ny jordbevægelsesmodel simulerer jordskælv, eksplosioner mere præcist
- Hvad er et eksempel på et biodigt?
- Hvad er et sort hul, og hvordan går OT fra?


