Er bindingen dannet mellem kulstof og bromionisk?
* Elektronegativitet: Carbon har en elektronegativitet på 2,55, mens brom har en elektronegativitet på 2,96. Forskellen i elektronegativitet (0,41) er ikke stor nok til at klassificere bindingen som ionisk. Ioniske bindinger dannes typisk, når elektronegativitetsforskellen er større end 1,7.
* Deling af elektroner: I en kovalent binding deler atomer elektroner for at opnå en stabil elektronkonfiguration. Carbon har brug for fire flere elektroner for at fylde sin ydre skal, og brom har brug for en mere. De danner en enkelt kovalent binding, hvor carbon deler en elektron med brom, og brom deler en elektron med kulstof.
Kortfattet: Bindingen mellem carbon og brom er kovalent, fordi de deler elektroner for at opnå stabilitet, og elektronegativitetsforskellen er ikke signifikant nok til at danne en ionisk binding.
 Varme artikler
Varme artikler
-
 Mikroenhed kunne opfange tidlige tegn på hjerteanfald eller slagtilfældeKredit:University of Sydney I Australien lider hvert år cirka 55.000 mennesker af et hjerteanfald, hvoraf et tilsvarende antal lider af slagtilfælde. Mange er forårsaget af blodpropper, der blokere
Mikroenhed kunne opfange tidlige tegn på hjerteanfald eller slagtilfældeKredit:University of Sydney I Australien lider hvert år cirka 55.000 mennesker af et hjerteanfald, hvoraf et tilsvarende antal lider af slagtilfælde. Mange er forårsaget af blodpropper, der blokere -
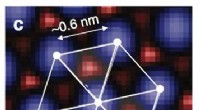 Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi -
 Ny undersøgelse forklarer skabelsen af geler, der frigiver pesticider og andre stoffer på en kon…Kredit:CC0 Public Domain Et hold koordineret af Santiago V. Luis og Belén Altava, fra Institut for Uorganisk og Organisk Kemi ved Universitat Jaume I, har udgivet en omfattende artikel, der omfatt
Ny undersøgelse forklarer skabelsen af geler, der frigiver pesticider og andre stoffer på en kon…Kredit:CC0 Public Domain Et hold koordineret af Santiago V. Luis og Belén Altava, fra Institut for Uorganisk og Organisk Kemi ved Universitat Jaume I, har udgivet en omfattende artikel, der omfatt -
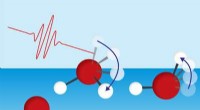 Vandoverflademolekyler mister energi ved rotation af den frie OH -gruppeFigur 1:I modsætning til andre vandmolekyler (røde kugler:oxygenatomer; hvide kugler:brintatomer), dem på overfladen har en fri hydroxylgruppe (OH). Tahei Tahara og hans team har brugt ultrahurtig spe
Vandoverflademolekyler mister energi ved rotation af den frie OH -gruppeFigur 1:I modsætning til andre vandmolekyler (røde kugler:oxygenatomer; hvide kugler:brintatomer), dem på overfladen har en fri hydroxylgruppe (OH). Tahei Tahara og hans team har brugt ultrahurtig spe
- Adskillelsesteknikker til methan og svovldioxid?
- Hvad er den eneste vigtige faktor, der kontrollerer udviklingen af en stjerne?
- Hvordan pasteurisering fungerer
- Magnetoelektrisk kobling i en paramagnetisk ferroelektrisk krystal demonstreret
- En ny følsom og stabil selvdrevet fotodetektor
- Hvad er det mindst antal atomer i en forbindelse?


