Hvorfor opløses alkoholer i koncentreret HCL?
Her er hvorfor:
* koncentreret HCL er en sur løsning. Mens alkoholer indeholder en hydroxylgruppe (OH), som kan deltage i hydrogenbinding med vand, er de ikke stærke nok baser til at reagere med koncentreret HCI til at danne et salt.
* opløselighed er baseret på "som opløser som." Alkoholer er generelt mere polære end ikke-polære forbindelser. De er dog stadig ikke så polære som koncentreret HCL, som er en meget polær opløsning. Derfor er alkoholer ikke let opløselige i koncentreret HCL.
Der er dog et par ting, der kan ske:
* Nogle alkoholer kan reagere med koncentreret HCL. Reaktionen kan involvere protonering af alkoholens ilt, hvilket fører til dannelse af en oxoniumion. Dette er en mere kompleks proces end simpel opløsning.
* Alkoholer kan opløses i fortyndet HCL. I fortyndet HCI er koncentrationen af protoner lavere, og interaktionen med alkoholer kan være mindre forstyrrende. Dette ville sandsynligvis resultere i en opløsning med en højere alkoholkoncentration end i koncentreret HCI.
Kort sagt, mens alkoholer muligvis gennemgår nogle reaktioner med koncentreret HCL, opløses de ikke i det på samme måde som de opløses i vand eller andre polære opløsningsmidler.
 Varme artikler
Varme artikler
-
 Smartphone lab leverer testresultater på spyt sekundProfessor Chong Ahn fra University of Cincinnati udviklede et bærbart laboratorium, der tilsluttes din smartphone for at diagnosticere sygdomme som malaria eller coronavirus. Resultaterne overføres ti
Smartphone lab leverer testresultater på spyt sekundProfessor Chong Ahn fra University of Cincinnati udviklede et bærbart laboratorium, der tilsluttes din smartphone for at diagnosticere sygdomme som malaria eller coronavirus. Resultaterne overføres ti -
 Dybt eutektiske opløsningsmidler erstatter forurenende industrielle opløsningsmidlerPh.d. -kandidat Dannie van Osch blander to pulvere, indtil de danner en flydende DES. Kredit:Bart van Overbeeke Mange forurenende opløsningsmidler, der bruges af den kemiske industri, kan erstatte
Dybt eutektiske opløsningsmidler erstatter forurenende industrielle opløsningsmidlerPh.d. -kandidat Dannie van Osch blander to pulvere, indtil de danner en flydende DES. Kredit:Bart van Overbeeke Mange forurenende opløsningsmidler, der bruges af den kemiske industri, kan erstatte -
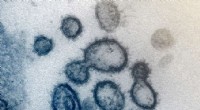 Nyt værktøj trækker undvigende COVID-19-markør fra menneskeblodDette transmissionselektronmikroskopbillede viser SARS-CoV-2 - også kendt som 2019-nCoV, virussen, der forårsager COVID-19 - isoleret fra en patient i USA. Viruspartikler er vist, der dukker op fra ov
Nyt værktøj trækker undvigende COVID-19-markør fra menneskeblodDette transmissionselektronmikroskopbillede viser SARS-CoV-2 - også kendt som 2019-nCoV, virussen, der forårsager COVID-19 - isoleret fra en patient i USA. Viruspartikler er vist, der dukker op fra ov -
 Belyser usynlige blodige fingeraftryk med en fluorescerende polymerFingeraftryksmønstre fremstillet i blod er tydeligt synlige på aluminiumsfolie (venstre) og malet træ (højre), når de udvikles med en fluorescerende polymer. Kredit:Tilpasset fra ACS Applied Materials
Belyser usynlige blodige fingeraftryk med en fluorescerende polymerFingeraftryksmønstre fremstillet i blod er tydeligt synlige på aluminiumsfolie (venstre) og malet træ (højre), når de udvikles med en fluorescerende polymer. Kredit:Tilpasset fra ACS Applied Materials
- Hvilken effekt har flydende nitrogen på molekylær kinetisk energi?
- Forskere udvikler en ny metode til levering af glukagon
- Når mennesker forbrænder fossile brændstoffer, hvilket vil stige?
- Santa Ana-vind og strømsvigt viste sig at ligge bag efterårs- og vinterbrande i det sydlige Califo…
- Blå hvirvelflammestruktur afsløret med supercomputere
- Hvad er en 100-års oversvømmelse? En hydrolog forklarer


